Otsing sellest blogist
UUS!!!
T-rakkude kurnatus
T-rakkude kurnatus ehk T-rakkude jõuetus ( T-cell exhaustion ) on toimivate T-rakkudega selgroogsetel loomadel esineda võiv kehasisen...
teisipäev, 6. jaanuar 2026
Metüleerimine
esmaspäev, 5. jaanuar 2026
Splaissosoom
Splaissosoom on suur ja keerukas RNA/valk-kompleks, mis lõikab eukarüootide tuumageenide primaarsetest transkriptidest välja intronid (seda protsessi nimetatakse splaissimiseks).
Splaissosoom koosneb snRNA-dest ja valgukompleksidest ning ta esineb ainult eukarüootsetes organismides.
Ülesehitus
Splaissosoomid sisaldavad snRNA-d (small nuclear RNA) ja üle 40 erineva valgu. Peamised snRNAd splaissosoomis on U1, U2, U3 (asub tuumakeses), U4, U5, ja U6. SnRNA-d ei ole tuumas vabalt, vaid kuuluvad väikestesse RNA-valk kompleksidesse, mida nimetatakse snRNP-deks (ing. k. small nuclear ribonucleo proteins), mis osalevad mitmetes RNA-RNA ja RNA-valk interaktsioonides. SnRNP-d on väga uridiinirikkad.
Splaissosoomi kokkupanek toimub uuesti igal hnRNA-l (pre-mRNA, heterogeneous nuclear RNA). HnRNA ahelal on kindlate järjestustega elemendid, mida tuntakse ära ja kasutatakse splaissosoomi kokkupanekuks. Nendeks on 5'-otsas asuv doonorsait, hargnemiskoha järjestus, polüpürimidiinitrakt, ja 3'-otsas asuv aktseptorsait. Nii splaissosoomi konformatsioon kui ka ülesehitus on väga liikuvad, mis tagavad splaissimise täpsuse ja universaalsuse.
Liigid
Leidub kaks erinevat ja unikaalset splaissosoomi, mis eksisteerivad koos enamikus eukarüootides. Nendeks on U2-sõltuv splaissosoom, mis katalüüsib U2-tüüpi intronite eemaldamist ja U12-tüüpi splaissosoom, mis eksisteerib vaid kindlates eukarüootides, kus lõikab välja haruldasi U12-tüüpi introneid.
U2- ja U12-tüüpi splaissosoomidel on palju mehaanilisi sarnasusi, mis viitavad ühisele eellasele ja võimaldavad meil rohkem aru saada splaissosoomi töömehhanismidest.
U2-tüüpi splaissosoom
U2 tüüpi splaissosoom pannakse kokku U1, U2, U5 ja U4/U6 snRNP-st ja paljudest mitte-snRNP valkudest.
U12-tüüpi splaissosoom
See sekundaarne splaissosoomi tüüp avastati alles 20. sajandi lõpus. Töötab väikeste intronite rühmadega, mida nimetatakse U12-tüüpi introniteks, sest nad sõltuvad teatud snRNP-st, mida kutsutakse U12-ks. U12-intronite roll ei ole veel selge, kuid nad on läbi evolutsiooni säilinud ja konserveerunud väga mitmekesiste liikide homoloogiliste geenide vahel ja seetõttu võib arvata, et neil on väga tähtis funktsionaalne roll. U12-tüüpi splaissosoomid pannakse kokku U11, U12, U5 ja U4atac/U6atac snRNP-dest. U12-tüüpi intronid eksisteerivad geenis peaaegu alati koos U2-tüüpi intronitega ja ei näita mingit positsioonilist kõrvalekallet, mis oleks seotud teiste intronitega geenis.
Funktsioon
Splaissosoom liitub intronite 5' ja 3' otste lähedal asuvatele kindlale järjestusele. Splaissosoomi kokkupanek pre-mRNA peale on reguleeritud protsess, mis vajab viit snRNP-d (U1–U6) ja mitmeid valke. Splaissimise protsessi katalüüs jätkub kindlate RNA-RNA, RNA-valk ja valk-valk interaktsioonidega, mis viivad eksoni väljalõikamiseni ja introni LARIAT vabanemiseni. Juhul kui introni nukleotiidne pikkus jääb vahemikku 200–250 nukleotiidi, pannakse splaissosoom kohe kokku üle terve introni.
Splaissosoomi kokkupanek
Splaissosoomi aktiivsaidi kokkupanek on väga kontrollitud ja astmeline protsess, mille käigus liidetakse snRNP partiklid pre-mRNA-le. Esmalt moodustatakse kompleks E: U1 snRNP seondub hnRNA 5' otsas asuvale doonorsaidile ja teistele mitte snRNP-dega seotud faktoritele. E kompleks on ATP-st sõltumatu kompleks, tänu millele saab toimuda splaissimine. Tänu E kompleksi komponendile U2AF, liidetakse pre-mRNA hargnemissaidile U2 snRNP. ATP-sõltuvas reaktsioonis seondub U2 snRNP tihedalt hargnemiskoha järjestusele ja moodustab kompleksi A, mis heidab ahelast välja adenosiini. U2 snRNA-s on pseudouridiini jäägid, mistõttu muutub RNA-RNA kompleksi konformatsioon ja saab toimuda splaissimise esimene samm. U4/U5/U6 tri-snRNP kaasatakse splaissosoomi kokkupanekusse, et moodustada kompleks B. Pärast seda toimub veel mitmeid ümberpaigutusi ja moodustub kompleks C, mis aktiveeritakse katalüüsiks. Hetkel on veel ebaselge, kuidas tri-snRNP kaasatakse kompleksi A, kuid see protsess võib toimuda läbi valk-valk interaktsioonide ja/või läbi U2 snRNA ja U6 snRNA aluspaaride interaktsioonide. Kompleks C katalüüsimisele järgnevad edasised ümberkorraldused juba aktiivses splaissosoomis.
Splaissimine
Enamus eukarüootseid geene sisaldavad mittekodeerivaid järjestusi – introneid. Selleks, et moodustuks transleeritav mRNA, toimub mittekodeerivate järjestuste väljalõikamine ja kodeerivate järjestuste ehk eksonite täpne ühinemine. Protsessi nimetatakse splaissinguks. Splaissing toimub etapiviisiliselt.
Esimene etapp
Esmalt katkestatakse fosfodiesterside introni 5´-splaissingu saidis introni GU järjestusest 5´-suunas. Protsessis osaleb kogu splaissosoom. Splaissingu saiti seondub otseselt U1 snRNP. Fosfodiesterside moodustub introni 5´-otsa ja konserveerunud A nukleotiidi vahel introni 3´-otsa lähedal.
Teine etapp
Seejärel seondub U2 snRNP introni splaissingu 3´-saiti, kus konserveerunud A nukleotiid on ühenduses introni 5´-otsaga (selliseid struktuure nimetatakse lariaatideks). Kompleksile lisanduvad ka teised snRNP-d, et moodustuks täielik splaissosoom, ning seejärel lõigatakse intron 3´- splaissingusaidist välja (fosfodiestersideme lõhkumine) ja eksonite vahel moodustub fosfodiesterside.
Alternatiivne splaissimine
Kui geenis sisaldub palju introneid, võidakse introneid RNA molekulist kõrvaldada kas eraldi või kombineeritult. Kui näiteks kaks kõrvuti paiknevat intronit eraldatakse korraga, võidakse kõrvaldada ka nendevaheline ekson. Nii moodustuvad erinevad mRNA molekulid, mis kodeerivad erinevaid polüpeptiide. Vastavat protsessi nimetatakse alternatiivseks splaissinguks.
reede, 2. jaanuar 2026
Splaissimine
Molekulaarbioloogias ja geneetikas on splaissimine ehk splaissing (ka splaising; inglise splicing) protsess, mille käigus lõigatakse rakutuumas asuvast RNA molekulist välja intronjärjestused ning allesjäänud eksonite otsad ühendatakse. Splaissingu tulemusena tekib mRNA, mida kasutatakse translatsioonil korrektse proteiini sünteesiks. Eukarüootsete intronite puhul katalüüsib splaissimisreaktsioone splaissosoom, kuid olemas on ka isesplaissuvaid introneid. Splaissosoom on väikeste tuuma ribonukleoproteiinide (inglise small nuclear ribonucleoprotein, snRNP) kompleks.
Splaissimise rajad
Looduses esineb erinevaid RNA splaissimismeetodeid. Splaissimistüüp sõltub splaissitava introni struktuurist ja katalüsaatorist, mida on splaissimise läbiviimiseks vaja.
Splaissosoomiga
Intronid
Eukarüootide geenid sisaldavad introneid, mille otsad on sarnased kõikides organismides. Mida lihtsama ehitusega organism, seda harvemad on intronid. Intronid on eksonite vahepealsed osad. Eksonid on kodeerivad järjestused. Splaissimiseks on vaja introni doonorsaiti (introni 5’ otsas), hargnemiskohta (introni 3’ otsa lähedal) ning aktseptorsaiti (introni 3’ otsas). Doonorsaidis on peaaegu alati GU nukleotiidijärjestus koos suurema, vähem konserveerunud regiooniga. Aktseptorsaidis, introni 3’ otsas, on nukleotiidijärjestuseks AG. AG-st ülespoole liikudes (5’ otsa suunas) leiab pürimidiiniderikka (C ja U) regiooni ehk polüpürimidiintrakti. Sellest 5’ otsa pool on hargnemiskoht, mis sisaldab A nukleotiidi. Punktmutatsioonid selles DNA regioonis või tranksriptsioonivead aktiveerivad peidetud splaiss-saidi (inglise cryptic splice site, CSS) transkripti osas, mida tavaliselt ei splaissita. Selle tulemiks on küps mRNA, millel on eksonist osa puudu. Punktmutatsiooni puhul, mis tavaliselt mõjutab ainult ühte aminohapet, saab vale aminohappe valgust lõpuks kustutada.
Formatsioon ja aktiivsus
Splaissimist viib läbi splaissosoom, mis on suur RNA valgukompleks, koosnedes viiest väiksemast tuuma ribonukleoproteiinist ning umbes 150 valgust. snRNPde RNA komponendid interakteeruvad introniga ja osalevad niimoodi katalüüsis. Eristatakse kahte erinevat splaissosoomi varianti (üldine ja minoorne), mis sisaldavad erinevaid snRNPsid.
- Üldine
- Üldine splaissosoom lõikab välja intronid, millel on 5’ otsas GU ja 3’ otsas AG järjestused. Splaissosoom koosneb U1, U2, U4, U5 ja U6 snRNPdest ning on aktiivne rakutuumas. Lisaks on vajalikud teatud hulk valke, kaasa arvatud U2AF ja SF1, et splaissosoom seonduks.
- E kompleks – U1 seondub GU järjestusele introni 5’ otsas koos valkudega/ensüümidega ASF/SF2, U2AF (seondub Py-AG saidis) ja SF1/BBP (BBP=Branch Binding Protein);
- A kompleks – U2 seondub hargnemiskohale. Selle jaoks hüdrolüüsitakse ATPd;
- B1 kompleks – U5/U4/U6 trimeer seondub: U5 seob ennast eksoniga 5’ saidis ning U6 seondub U2ga.
- B2 kompleks – U1 vabastatakse, U5 liigub eksonilt intronile ning U6 seondub 5’ otsa splaiss-saidis.
- C1 kompleks – U4 vabastatakse, U6/U2 katalüüsib transesterifikatsioonireaktsiooni, mille käigus introni 5’ ots ligeerub A saiti intronil ja moodustab lasso-taolise struktuuri. U5 seondub eksoniga 3’ splaiss-saidis ning introni 5’ ots lahkneb, formeerudes lasso.
- C2 kompleks – U2/U5/U6 jääb tekkinud lasso külge seotuks, eksoni 3’ ots on vaba ning eksonid ligeeritakse ATP hüdrolüüsi arvelt. Splaissitud RNA vabastatakse ning lasso hargneb lahti.
- Sellist splaissimise tüüpi nimetatakse kanooniliseks splaissinguks või lasso rajaks, mis toimub 99% kordadest. Samas kui intronid ei järgi GU-AG reeglit, toimub mittekanooniline splaissimine (vaata alt "minoorne splaissosoom").
- Minoorne
- Minoorne splaissosoom sarnaneb väga üldise splaissosoomiga, ainult et see splaissib haruldasi introneid, millel on splaiss-saitides teistsugused nukleotiidijärjestused. Kui U5 on nii üldisel kui minoorsel splaissosoomil sama, siis minoorsel on U1, U2, U4 ja U6 asemel erinevad, kuid funktsionaalselt analoogsed snRNPd, vastavalt U11, U12, U4atac ja U6atac. Nagu üldinegi, on minoorne splaissosoom leitav ainult rakutuumas.
- Trans-splaissimine
- Trans-splaissimine on splaissimise vorm, kus liidetakse kaks eksonit, mis ei ole samas RNA transkriptis.
Isesplaissumine
Isesplaissumine leiab aset vähestes intronites, mis moodustavad ribosüümi. Ribosüüm on võimeline katalüüsima splaissosoomile omaseid reaktsioone. On olemas kolm gruppi isesplaissuvaid introneid: grupp I, grupp II ja grupp III. Grupp I ja II intronid teostavad splaissimise sarnaselt splaissosoomiga, ilma et vajaks teisi valke. Selline sarnasus viitab sellele, et grupi I ja II intronid võivad olla evolutsiooniliselt suguluses splaissosoomiga. Isesplaissumine võib olla ka väga vana ning võis eksisteerida RNA maailmas enne vajalikke valke. Kuigi nimetatud kaks mehhanismi ei vaja toimumiseks teisi proteiine, on vaja siiski viit RNA molekuli ja üle 50 valgu, et kasutada ja hüdrolüüsida palju ATP molekule. Splaissimismehhanismid kasutavad ATP energiat, et mRNA splaissimine oleks täpne. Kui ATPd ei kasutataks, oleks protsess väga ebatäpne ning vigaderohke.
Grupi I intronite splaissumist iseloomustavad kaks transesterifikatsioonireaktsiooni:
- Vaba guaniini nukleosiidi 3’OH rühm või nukleotiidi kofaktor (GMP, GDP, GTP) ründab 5’ splaiss-saidis fosfaatrühma.
- 3’OH rühm 5’ eksonis muutub nukleofiiliks ning teise transesterifikatsiooni lõpuks liidetakse kaks eksonit.
Mehhanism, kus grupp II intronid splaissuvad (kaks transesterifikatsioonireaktsiooni, nagu grupp I) on sellised:
- Spetsiifilise adenosiini 2’OH rühm intronis ründab 5’ splaiss-saiti, moodustades lasso.
- 5’ eksoni 3’OH päästab valla teise transesterifikatsiooni 3’ splaiss-saidis ning eksonid liidetakse omavahel.
tRNA splaissimine
tRNA splaissimine on järjekordne haruldane splaissimisvorm, mis tavaliselt toimub tRNAs. Splaissimisreaktsioonides on splaissosoomist ja isesplaissuvast rajast erinev biokeemia. Ribonukleaasid vabastavad RNA ning ligaasid ühendavad eksonid.
Evolutsioon
Splaissimine toimub kõigis elu domeenides ja riikides, kuid splaissimise ulatus ja tüübid on väga erinevad. Eukarüoodid splaissivad palju valku kodeerivaid mRNAsid ning mõnesid mittekodeerivaid RNAsid. Prokarüoodid splaissivad harva ning enamjaolt mittekodeerivaid järjestusi. Teine tähtis erinevus kahe rühma vahel on see, et prokarüootidel puudub splaissosoomne rada.
Kuna splaissosoomsed intronid pole kõigis liikides konserveerunud, on tekkinud debatt teemal, millal splaissosoomne splaissing evolutsioneerus. Pakutakse nii varajast (inglise intron-early model) kui ka hilist introni mudelit (inglise intron-late model).
| Eukarüoodid | Prokarüoodid | |
|---|---|---|
| Splaissosoomiga | + | − |
| Isesplaissumine | + | + |
| tRNA | + | + |
Biokeemiline mehhanism
Splaissosoomne ning isesplaissumine koosneb kahe-astmelisest biokeemilisest protsessist. Mõlemaks astmeks on transesterifikatsioonireaktsioon, mis toimub RNA nukleotiidide vahel. tRNA splaissimine on erand ega vaja transesterifikatsiooni.
Esiteks teostab introni hargnemispunkti nukleotiidi 2’OH rühm nukleofiilse rünnaku introni 5’ splaiss-saidis asuvale esimesele nukleotiidile, moodustades lasso-kujulise vaheühendi. Teiseks ründab vabaks jäänud 5’ eksoni 3’OH omakorda introni 3’ splaiss-saidi viimast nukleotiidi, ühendades eksonid ja vabastades introni.
Alternatiivne splaissing
Splaissimisprotsess võib mitmetes olukordades luua unikaalseid valke, varieerides eksonite kompositsiooni samas mRNAs. Sellist fenomeni kutsutakse alternatiivseks splaissimiseks. Alternatiivne splaissimine võib toimuda mitmel viisil. Eksoneid võib nii pikendada kui ka vahele jätta või introneid alles jätta.
Eksperimentaalne splaissimise manipulatsioon
Splaissimissündmusi saab eksperimentaalselt mõjutada, kui seondada snRNPde seondumissaitidesse, hargnemispunkti nukleotiidi külge või regulatoorsetesse saitidesse steerilisi-blokeerivaid antisense oligonukleotiide (inglise steric-blocking antisense oligos), nagu morfoliine või peptidonukleiinhappeid (PNA).
Splaissimisvead
Tüüpilised vead:
- Mutatsioon splaiss-saidis, mille tulemusena kaob saidi funktsioon. Võib tekkida enneaegne stoppkoodon, kaduda ekson või sisse jääda intron.
- Mutatsioon splaiss-saidi redutseerimise spetsiifilisuses. Tulemusena võib varieeruda splaissimise koht, põhjustades aminohapete sisestusi või deletsioone, kõige tõenäolisemalt aga lugemisraami nihet.
- Splaiss-saidi vale asetus, mis viib suurema osa RNA sisse või välja jätmisele, kui algselt oodatud. Põhjustab pikemaid või lühemaid eksoneid.
Paljud splaissimisvead kontrollib üle rakusisene kvaliteedikontrolli mehhanism, mida nimetatakse nonsense mediated mRNA decay (NMD).
Valgu splaissimine
Lisaks RNAle läbivad ka valgud splaissimise. Kuigi biomolekulaarsed mehhanismid on erinevad, on printsiip siiski sama: inteiinid, intronite asemel, eemaldatakse. Alles jäänud osad, mida nimetatakse eksteiinideks, liidetakse omavahel. Valgu splaissimist on vaadeldud paljudel organismidel, kaasa arvatud bakteritel, arhedel, taimedel, pärmidel ning inimestel.
kolmapäev, 31. detsember 2025
Metaboolne atsidoos
Metaboolne atsidoos on häire, mis väljendub organismi vereplasmas oleva bikarbonaadi sisalduse vähenemises.
Sisukord
Metaboolse atsidoosi vormidRedigeeri
Metaboolsel atsidoosil on kaks vormi. Ühel juhul anioonide vahe plasmas jääb normaalseks, teisel juhul see suureneb.
Metaboolne atsidoos normaalse anioonide vahegaRedigeeri
See vorm on põhjustatud bikarbonaadi gastrointestinaalsetest ja renaalsetest kadudest. Gastrointestinaalsete kadude hulka kuuluvad, nagu eelpool mainitud, oksendamine ja kõhulahtisus. Renaalsete kadude alla kuuluvad proksimaalne renaalne tubulaaratsidoos ja distaalne renaalne tubulaaratsidoos.
Proksimaalne renaalne tubulaaratsidoosRedigeeri
Proksimaalne renaalne tubulaaratsidoos tekib siis, kui bikarbonaadi tagasihaarde mehhanism proksimaalses tuubulis on kahjustunud. See kujuneb välja järgmistel põhjustel:
- amüloidoos
- nefrootiline sündroom
- raskmetallide mürgistused (nt kaadmium avaldab kahjulikku mõju kaltsiumiainevahetusele ning see võib esile kutsuda raku surma)
Distaalne renaalne tubulaaratsidoosRedigeeri
Distaalse renaalse tubulaaratsidoosi kutsub esile kogumistorukeste talitlushäire ning kahjustatud on H+ tagasihaarde mehhanismid. See on tingitud järgmistest haigustest:
Metaboolne atsidoos suurenenud anioonide vahegaRedigeeri
Metaboolse atsidoosi korral on vereplasmas anioonide vahe suurenenud. Põhjused:
- orgaaniliste hapete ülehulk
- mürgistused
- anorgaaniliste hapete ülehulk
Organismi reaktsioonid metaboolse atsidoosi kõrvaldamiseksRedigeeri
Organism vastab metaboolsele atsidoosile kolmel viisil. Esiteks püüab ta taastada vereplasma normaalse pH, teiseks langetada kopsude vahendusel PaCO2 ja neerude kaudu takistada bikarbonaadi liigekskretsiooni.
teisipäev, 30. detsember 2025
Ketoatsidoos
Ketoatsidoos on ainevahetushäire, mida iseloomustab ketokehade kõrgenenud tase veres ja metaboolne atsidoos.
Sisukord
Ketokehad ja diabeetRedigeeri
Ketokehad on atsetoained. Inimese organismis on peamised atsetoained atsetoatseaat ja 3-hüdroksübutüraat. Kui organismis on ketogeenne aktiivsus suur, on hingeõhus tunda atsetooni lõhna.
Ketoatsidoos (diabeetiline)Redigeeri
Ketoatsidoos on diabeediga inimestel tekkida võiv ohtlik seisund, mis on põhjustatud insuliinivaegusest või hüpoglükeemiast. Mida täielikum on insuliinivaegus, seda intensiivsem on rasvade lõhustamine rasvkoes ja seda enam vabaneb verre ka rasvhappeid. Tekib olukord, kus rasvhappeid tuleb põletada energia saamiseks, kuid rasvhapped ei põle lõpuni, sest glükoos ei pääse rakkudesse ning seda ei saa seal põletada. Tagajärjeks on ketoainete põhjustatud happemürgisus (ketoatsidoos), juhul kui organism ei saa kiiresti lisaks vajalikul määral insuliini. Algava ja juba arenenud ketoatsidoosi korral on vere suhkrusisaldus alati suur ja uriinis on alati ohtralt nii suhkruid kui ka ketoaineid. Nende ainete sisaldus veres ja uriinis kasvab kiiresti senikaua, kui süstitakse vajalik kogus lisainsuliini. Ketoatsidoos võib tekkida diabeetikul ka hüpoglükeemia (liiga väike suhkrusisaldus veres) korral, kui veres on liiga vähe glükoosi, ei piisa selle põlemisest rakkudes, et põletada rasvhapped täielikult. Sellises olukorras nimetatakse ketoaineid näljahapeteks.
Ketoatsidoosi tunnusedRedigeeri
- iiveldus ja oksendamine
- dehüdratsioon ehk janu
- puuvilja- või atsetoonilõhnaline aroom hingeõhus
- kiire kaalulangus
- raskendatud või sügav, meeleheitlik hingamine
- kõhuvalu
- kiirenenud südamerütmika
- segadusseisund ja/või desorientatsioon
- kooma
Ketokehade mõõtmine verestRedigeeri
Ketokehi peaks mõõtma, kui veresuhkur ületab 17 mmol/l või kui veresuhkur on olnud pikemat aega üle 13 mmol/l. Diabeetilist ketoatsidoosi diagnoositakse tavaliselt vere- ja uriinianalüüside abil, mis mõõdavad ketoonide sisaldust veres või uriinis.
Ketokehade testi tulemusedRedigeeri
–alla 0,6 mmol /L – normaalne vere ketooni väärtus –0,6 kuni 1,5 mmol /L – näitab, et toodetakse rohkem ketoone kui tavaliselt, testida hiljem uuesti, et näha, kas väärtus on langenud –1,6 kuni 2,9 mmol /L – suur ketoonide sisaldus, võib esineda ketoatsidoosi oht. Soovitatav on pöörduda oma raviarsti poole. –üle 3,0 mmol /L – ketoonide ohtlik tase, mis vajab viivitamatut arstiabi
Ketoatsidoosi vältimineRedigeeri
- Veresuhkru taseme kontrolli all hoidmine;
- endokrinoloogi antud raviplaani järgimine;
- viirushaiguse korral tuleb veresuhkrut kontrollige tavalisest sagedamini; kui see on korduvalt üle 13 mmol/l, tuleb iga 4–6 tunni järel määrata ketoone ka verest.
esmaspäev, 29. detsember 2025
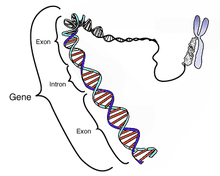
Intron
Intron on geenis olev nukleotiidne järjestus, mis eemaldatakse RNA splaissimise käigus, kui valmistatakse RNA produkt, millelt toimub translatsioon. Intronid ja eksonid geenis transkribeeritakse RNA molekuliks ning eksonid liidetakse kokku RNA lõpp-produktiks, kui intronid on eemaldatud. Intron on geeni mittekodeeriv piirkond.
Terminit intron kasutatakse nii DNA sees olevate intronite iseloomustamiseks kui ka RNA sees olevate intronite iseloomustamiseks.
Järjestused, mis hiljem kokku liidetakse RNA valmistamiseks, on moodustunud eksonitest pärast RNA splaissimist. Intronid esinevad enamiku organismide geenides ning ka paljudes viirustes. Introneid esineb paljudes geenides, ka neis, mis genereerivad valke, ribosomaalset-RNAd (rRNA) ja transport-RNAd (tRNA). RNA töötlemine toimub enne translatsiooni ning pärast transkriptsiooni.
Sõna intron tuleb ingliskeelsest väljendist intragenic region (geenisisene piirkond), mis tähendab geeni sees olevat ala.
Klassifikatsioon
On teada vähemalt nelja eri tüüpi introneid.
- isesplaissuvad grupp I intronid, mis eemaldatakse RNA katalüüsi käigus
- isesplaissuvad grupp II intronid, mis eemaldatakse RNA katalüüsi käigus
- intronid tuuma valke kodeerivates geenides, mille eemaldavad splaissosoomid
- intronid tuuma ja arhe transport-RNA geenides, mille eemaldavad valgud (tRNAd lõikavad ensüümid)
Pakutakse ka grupp III introneid omaette perekonnana, kuid neist teatakse veel vähe.
Grupp I ja grupp II introneid leidub valke kodeerivate geenides (informatsiooni-RNA ehk mRNA), transport-RNA ja ribosomaalses RNAs paljudel organismidel. Pärast RNA transkriptsiooni teevad I grupi ja II grupi intronid läbi ulatusliku sisemise interaktsiooni, mis lubab neil kolmedimensiooniliseks kujundiks kokku voltuda. Nende intronite RNA moodustab keerulise konserveerunud sekundaarsturuktuuri. See võimaldab neil intronitel olla isesplaissuv. Intronit sisaldav RNA molekul muudab enda kovalentstruktuuri, et täpselt eemaldada intron ning kleepida eksonid omavahel õiges järjekorras kokku. Mõnel juhul osalevad splaissimises ka spetsiaalsed introneid siduvad valgud, mis aitavad introneid voltida isesplaissumiseks vajalikku kolmedimensionaalsesse struktuuri.
Tuuma pre-mRNA intronid (splaissosoomiga eemaldatavad intronid) on ära määratud spetriaalsete intronite järjestustega, mis asuvad eksonite ja intronite vahealadel. Need järjestused tuntakse ära splaissosoomse RNA molekulide abil, kui alustatakse splaissimisreaktsioonidega. Tuuma pre-mRNA intronid on tihti palju pikemad kui neid ümbritsevad eksonid.
Bioloogilised funktsioonid ja evolutsioon
Esialgsel hindamisel saab introneid vaadata kui tähtsusetuid järjestusi, mille ainus funktsioon on eemalduda splaissimata algsest RNAst, et valmistada funktsionaalne mRNA, rRNA või tRNA produkt. Siiski, mõned intronid ise kodeerivad spetsiifilisi valke või neid introneid töödeldakse edasi hiljem pärast splaissimist, et genereerida mittekodeerivaid RNA molekule. Alternatiivne splaissimine on laialt kasutusel, et valmistada palju valke ühest geenist, tegemist on post-translatsioonilise geeniregulatsiooniga. Mõned intronid esindavad mobiilseid geneetilisi elemente ja võidakse lugeda kui näideteks isekast DNAst.
Intronite bioloogiline päritolu on selgusetu. Pärast esimest intronite avastust valke kodeerivates geenides eukarüootide rakutuumades, käis arutelu selle üle, kas intronid tänapäevastes organismides on pärit ühisest eellasest või on intronid üsna hiljuti evolutsiooniprotsessis tekkinud. On ka teine teooria: splaissosoom ja intron-ekson struktuurid geenides on jäänuk RNA maailmast. Käib arutelu ka selle üle milline neist hüpoteesidest on õigeim. Viimane populaarne konsensus hetkel on, et intronid on jäänud eukarüootsesse liini isekate elementidena.
Varajased genoomse DNA järjestuse uuringud paljudes organismides on näidanud, et intron-ekson struktuurid homoloogilistes geenides erinevates organismides võivad suuresti varieeruda. Hiljutisemad uuringud kogu eukarüootse genoomi kohta on näidanud, et intronite pikkus ja tihedus varieerub palju sugulasliikide vahel. Näiteks inimese genoom sisaldab keskmiselt umbes 8,4 intronit geeni kohta (139 418 genoomis), üherakuline seen Encephalitozoon cuniculi sisaldab ainult 0,0075 intronit geeni kohta (15 intronit genoomis)). Introneid on evolutsioonis ulatuslikult tekkinud ja/või kadunud evolutsioonis alates eukarüootide ühise eellase lahknemisest. Arvatavasti on see protsess selektsiooni tulem, kalduvusega intronite juurdetekkimisega suuremates liikides nende väiksemate populatsioonide tõttu ja vastupidine efekt toimub väiksemate liikide puhul (eriti üherakulistel liikidel). Bioloogilised faktorid mõjutavad ka millistes geenides intronid kaovad või juurde tekivad.
Intronite alternatiivne splaissimine geenides tekitab suuremat varieetilisust valkude järjestustes, mis transleeritakse ühest geenist, see lubab toota mitmeid erinevaid valke ühest geenist. Alternatiivse RNA splaissimise kontroll teostatakse erinevate signaalmolekulide abil, mis vastavad paljudele rakusisestele ja rakuvälistele signaalidele.
Intronid kui mobiilsed geneetilised elemendid
Intronid võivad evolutsioonis minna kaduma või tekkida juude nagu on selgunud paljude ortoloogiliste geenide uuringutest. Selgunud on kaks üldtunnustatud mehhanismi intronite kadumisest, pöördtranskriptaasi-vahendatud intronite kadu (Reverse Transcriptase-Mediated Intron Loss ehk RTMIL) ja genoomideletsioonid. Lõplikud mehhanismid intronite tekkimisest on kirjeldamata ja vastuolulised. Hetkel on teada vähemalt seitse intronite tekkemehhanismi: introni transpositsioon, transposooni insertsioon, tandem genoomi duplikatsioon, introni ülekanne, introni teke homoloogilise rekombinatsiooni tulemusel (DSBR rada), grupp II introni insertsioon ja intronisatsioon.
Introni transpositsiooni korral arvatav introni tekkemehhanism on kui splaissitud intron pöördsplaissub kas enda mRNA või mõne teise mRNA sisse, kus eelnevalt polnud intronit. Intronit sisaldav mRNA seejärel pöördtranskribeeritakse ja tulemuseks on intronit sisaldav cDNA, mis seejärel võib põhjustada intronitekke täieliku või osalise rekombinatsiooni tulemusena oma orignaalgeenilookusesse.
Transposooni insertsioonid võivad ka tulemuseks anda introni tekke. Kui transposoon asetub AGGT järjestusse, duplitseerub see järjestus mõlemal pool transposooni ning selline insertsioon võib introniseerida transposooni, rikkumata koodijärjestust.
Tandemgeeniduplikatsiooni korral doonor- ja aktseprotsplaissimissaitides (mõlemal on AGGT järjestusele sarnane järjestus) eksonisegmendis AGGT järjestuses tandemgeeniduplikatsioon genereerib kaks potentsiaalset splaissumissaiti. Kui splaissosoom selle koha ära tunneb, siis originaalse ja duplitseeritud AGGT vahel olev järjestus splaissitakse geeni koodijärjestust muutmata.
Introni ülekande korral saab pseudogeen või paraloogne geen introni ja siis kannab selle introni üle rekombinatsiooni teel õdeparaloogi, kust intron puudub.
Intronisatsiooni korral tekitavad mutatsioonid uued intronid varasematest eksonijärjestustest. Selle mehhanismi korral ei toimu insertsiooni või DNA generatsiooni.
-
Muusika astmed ei ole noodid. Astmete redel algab 1. astmest ja lõppeb 8. astmega. Kõikide helistike heliredel algab 1. astmest. Astmetel...
-
EESTI RAHVAKALENDRI PÜHAD: JAANUAR Talvine kalapüük Mootse talus . ERA, Foto 17846. Kolmekuningapäev (6. I) Nuudipäev (7. I)...