G-valguga seotud retseptorid (ingl k G protein-coupled receptors (GPCR)) moodustavad suure osa valguliste retseptorite perekonnast, mis tuvastavad rakuväliseid molekule ja aktiveerivad rakusiseseid signaaliülekande radasid, mille tagajärjel saavutatakse bioloogiline vastus (igasugune muutus raku olekus või aktiivsuses, näiteks liikumine, ainete sekreteerimine, ensüümide tootmine, geenide ekspressioon jne.). GPCR-id on membraanisisesed valgud, millel on seitse membraani läbivat domeeni (transmembraanset heeliksit).
G-valguga seotud retseptoreid leidub ainult eukarüootides, sealhulgas pärmis, kaelusviburlastes ning teistes loomades. GPCR-ile seostuvad ja neid aktiveerivad ligandid võivad olla valgustundlikud ühendid, lõhnaained, feromoonid, hormoonid või neurotransmitterid ning varieeruvad mõõtmetelt väikestest molekulidest suurte valkudeni. G-valguga seotud retseptorid on seotud paljude haigustega ning on ligi 40% moodsate ravimite sihtmärgiks. 2012. aasta Nobeli keemiaauhind anti Brian Kobilkale ja Robert Lefkowitzile nende töö eest G-valguga seotud retseptoritega.
G-valguga seotud retseptoritel on kaks põhilist signaalirada: cAMPi signaalirada ja fosfatidüülinositooli signaalirada. Kui ligand seostub GPCR-ile, toimub viimases konformatsioonimuutus, mis laseb sel käituda guaniini nukleotiidi vahetusfaktorina (ingl k Guanine nucleotide exchange factor ehk GEF). GPCR saab seejärel aktiveerida seotud G-valgu, asendades sellele seotud guanosiindifosfaadi (GDP) guanosiintrifosfaadiga (GTP). G-valgud koosnevad kolmest alaühikust (valgumolekulist, mis seostub teiste valgumolekulidega ja moodustab nendega kompleksi): alfa (α), beeta (β) ja gamma (γ), kusjuures α-alaühik on seotud GDP või GTP-ga ning β- ja γ-alaühikud moodustavad püsiva dimeerse βγ kompleksi. G-valgu α-alaühik koos GTP-ga saab dissotsieeruda β- ja γ-alaühikute küljest, et mõjutada rakusiseseid signaalmolekule või sihtmärke, sõltuvalt α-alaühiku tüübist.
KlassifikatsioonGPCR-i perekonna täpne suurus on teadmata, aga inimese genoomi järjestuse analüüsil on leitud ligi 800 geeni (umbes 4% tervest valke kodeerivast genoomist), mis eeldatavasti kodeerivad G-valguga seotud retseptoreid. Kuigi välja on pakutud paljusid klassifitseerimise skeeme, jagatakse G-valguga seotud retseptorite perekond klassikaliselt kolme põhiklassi (A, B ja C), kus klasside järjestuste vahel pole tuvastatavat homoloogiat. Kõige suurem klass on A, kuhu kuulub ligi 85% GPCR geenidest. A-klassi kuuluvatest geenidest omakorda üle poolte kodeerivad maitsmismeele retseptoreid, ülejäänutele vastavad teadaolevad endogeensed ligandid või liigitatakse orbretseptorite alla. Järjestuse homoloogiate puudumisele vaatamata on eri klasside GPCR-id ühesuguse struktuuriga ja signaaliülekande mehhanismiga. Kokkuvõtvalt saab G-valguga seotud retseptorid jagada kuude klassi, põhinedes järjestuste homoloogial ja funktsionaalsetel sarnasustel:
Väga suur rodopsiini A-grupp jaguneb täiendavalt 19 alagrupiks (A1-A19). C-klassi hulka liigitatakse veel mõned retseptorid, näiteks teatud orbretseptorid ja gamma-aminobutüürhappe B (GABA(B)) retseptor.
Füsioloogiline rollG-valguga seotud retseptorid on seotud väga paljude füsioloogiliste protsessidega. Mõned näited nende füsioloogilisest rollist:
- Nägemismeel: opsiinid muudavad elektromagnetkiirguse rakusignaaliks fotoisomerisatsiooni reaktsiooni abil. Näiteks rodopsiin muundab 11-cis-retinaali trans-retinaaliks.
- Maitsmismeel: GPCR-id maitsmisrakkudes vahendavad gustdutsiini vabanemist mõru ja magusa maitsega ainete söömisel.
- Haistmismeel: haistmisrakkude (olfaktoorne epiteelkude) retseptorid seovad lõhnaaineid ja feromoone.
- Käitumise ja meeleolu regulatsioon: imetajate ajus olevad retseptorid seovad mitmesuguseid neurotransmittereid, nende hulgas serotoniini, dopamiini, GABA-t ja glutamaati.
- Immuunsüsteemi aktiivsuse ja põletiku regulatsioon: kemokiini retseptorid seovad ligande, mis vahendavad immuunsüsteemi rakkude vahelist suhtlust; mõned retseptorid, näiteks histamiini retseptor, seovad põletiku vahendajaid ja suunavad kindlaid rakutüüpe põletikulist vastust andma.
- Autonoomse närvisüsteemi ülekanded: GPCR-id reguleerivad nii sümpaatilist kui parasümpaatilist närvisüsteemi, mis vastutavad paljude keha iseeneslike protsesside kontrolli eest, nagu vererõhk, pulss ja seedimisprotsessid.
- Homöostaasi moduleerimine.
- On seotud mõnda tüüpi kasvajate kasvu ja levikuga.
StruktuurGPCR on membraanisisesed valgud, millel on seitse membraani läbivat domeeni (transmembraanset heeliksit). Retseptori rakuvälised osad võivad olla glükosüleeritud. Need rakuvälised aasad sisaldavad ka kahte tsüsteiinijääki, mis moodustavad disulfiidsidemeid, mis stabiliseerivad retseptori struktuuri. Varajased G-valguga seotud retseptorite struktuurid põhinesid nende nõrgal analoogial bakterirodopsiiniga, mille struktuur oli määratud nii elektrondifraktsiooni kui ka röntgenkristallograafia abil. Aastal 2000 õnnestus saada esimene imetaja GPCR-i (veise rodopsiini) kristallstruktuur. Kuigi retseptori põhiosa, seitse transmembraanset heeliksit, on ühesugune, erineb heeliksite paiknemine üksteise suhtes märgatavalt bakterirodopsiinist. 2007. aastal saadi ka esimene inimese GPCR-i struktuur. Kohe järgnes ka kõrgema eraldusvõimega struktuur samast retseptorist. See inimese β2-adrenergilise retseptori struktuur osutus väga sarnaseks veise rodopsiiniga heeliksite paiknemise osas. Samas on teise rakuvälise silmuse konformatsioon kahel struktuuril täiesti erinev. Kuna see silmus moodustab "kaane", mis katab ligandi sidumistaskut, illustreerib see konformatsioonide erinevus homoloogia mudelite loomise raskusi, põhinedes ainult rodopsiini struktuuril.
Eraldatud on ka aktiveeritud ja/või agonisti sidunud GPCR-ide struktuurid. Need struktuurid näitavad, kuidas ligandi seostumine rakuvälises osas muudab retseptori rakusisese osa konformatsiooni. Suurim muutus on viienda ja kuuenda heeliksi väljapoole liikumine. Aktiveeritud β2-adrenergiline retseptor kompleksis Gs-iga (G-valk, mis aktiveerimisel stimuleerib adenülaadi tsüklaasi) kinnitas, et G-valgu α-alaühik seostub selle liikumise tulemusel tekkinud taskusse.
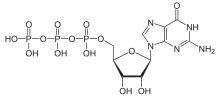
LigandidGPCR-ide ligandide nimekiri on küllaltki pikk. Nende hulka kuuluvad adenosiin, bombesiin, endoteliin, γ-aminobutüürhape (GABA), melanokortiinid, neuropeptiid Y, opioidpeptiidid, opsiinid, somatostatiin, biogeensed amiinid (nt dopamiin, epinefriin, norepinefriin, histamiin, glutamaat, atsetüülkoliin ja serotoniin), kemokiinid, lipiidsed põletiku vahendajad (nt prostaglandiinid, prostanoidid, leukotrieenid), peptiidhormoonid (nt folliikuleid stimuleeriv hormoon (FSH), gonadotropiini vabastav hormoon (GnRH), neurokiniin, kannabinoidid). G-valguga seotud retseptorid, mille ligande veel tuvastatud pole, nimetatakse orbretseptoriteks. Kui teiste uuritud retseptorite tüüpidel seostuvad ligandid membraani välispinnal, siis GPCR-idel toimub sidumine üldiselt transmembraanses osas.
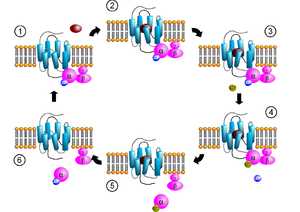
Konformatsiooni muutumineG-valguga seotud retseptor aktiveeritakse välise signaaliga ligandi või mõne teise signaalikandja vahendusel. See põhjustab retseptori konformatsiooni muutuse, mis omakorda aktiveerib G-valgu. Edasine efekt sõltub G-valgu tüübist.
Signaaliülekanne läbi membraani pole päris selge. On teada, et inaktiivne G-valk on seotud retseptorile passiivses olekus. Kui ligand on seostunud, muutub retseptori konformatsioon ja aktiveerib seega mehaaniliselt G-valgu, mis vabaneb retseptori küljest. Retseptor saab seejärel siduda ja aktiveerida uue G-valgu või minna tagasi inaktiivsesse olekusse. See on küll väga lihtsustatud selgitus, aga annab toimuvast üldise ülevaate.
Usutakse, et retseptori molekulil on konformatsiooniline tasakaaluolek aktiivse ja inaktiivse oleku vahel. Ligandi seostumine võib seega nihutada tasakaalu aktiivse oleku poole. Agonistid nihutavad seega tasakaalu aktiivse oleku poole, pöördagonistid inaktiivse oleku poole ja antagonistid tasakaalu ei mõjuta. Aktiivse ja inaktiivse oleku erinevused pole siiski päris täpselt teada.
G-valgu aktivatsioon/deaktivatsioonKui retseptor on passiivses olekus, võib GEF domeen olla seotud inaktiivse G-valgu α-alaühikuga. G-valgud on heterotrimeersed, s.t. need koosnevad kolmest alaühikust (α, β, γ). α-alaühik on aktiivses olekus seotud guanosiintrifosfaadiga (GTP) ja inaktiivses olekus guanosiindifosfaadiga (GDP) (või puudub guaniini nukleotiid). Retseptori aktiveerimisel aktiveerib GEF domeen G-valgu, vahetades GDP GTP vastu. Rakus hoitakse tsütosoolselt GTP:GDP suhet 10:1, mistõttu on GTP seostumine soodustatud. G-valgu aktiveerimisel dissotsieerub G-valk retseptori küljest ning jaguneb kaheks osaks: α-alaühikuks (koos GTP-ga) ning βγ dimeeriks, mis saavad edasi teiste rakusiseste valkude aktiivsust mõjutada. Kuna α-alaühikul on aeglane GTP hüdrolüüsi võime, taastub ajapikku inaktiivne α-alaühik, mis saab taas seostuda βγ-dimeeriga, moodustades taas inaktiivse G-valgu trimeeri. See saab jälle omakorda seostuda retseptorile ja oodata aktiveerimist.