Mutagenees on protsess, mille käigus toimuvad organismi DNA-järjestuses muutused ehk mutatsioonid, mis jäävad genotüüpi püsima. Mutatsioonid võivad tekkida füüsikaliste, keemiliste ja bioloogiliste tegurite toimel. Mutageneesi võib jagada spontaanseks ja indutseerituks.
Mutageneesi võivad põhjustada kas endogeensed või eksogeensed faktorid. Endogeensete faktorite hulka kuuluvad spontaanne hüdrolüüs, hapniku vabad radikaalid või vead replikatsiooni- ja reparatsioonimehhanismides. Mutageneesi eksogeensete põhjuste hulka kuuluvad keskkondlikud mutageenid. Toimemehhanism sõltub mutageenist. Suurem osa mutageenidest mõjutavad otseselt või kaudselt DNA-d ja kahjustavad seda, mõned võivad mõjutada replikatsiooni ja teisi rakus toimuvaid protsesse.
Paljud kemikaalsed mutageenid vajavad bioloogilist aktivatsiooni, et muutuda mutageenseks. Näiteks tsütokroom P450 on oluline ensüümide perekond, mis toodab mutageenseid metaboliite. Mutageene, mis vajavad bioloogilist aktivatsiooni, nimetatakse promutageenideks.
Paljud mutatsioonid tekivad DNA kahjustuse tulemusena replikatsiooni käigus. Bakterirakkudes põhjustavad mutageenid üheahelalise DNA tühiku (single-stranded DNA gap) teket, mis kutsub esile SOS-vastuse. SOS-vastus on reparatsiooniprotsess, mis kasutab veaalteid DNA polümeraase. Selle ensüümi vähese veatundlikkuse tõttu võivad mutatsioonid püsima jääda. Imetajarakkudes indutseerib replikatsiooni peatumine kahjustatud piirkonnas mitmeid päästesüsteeme, mis aitavad samuti DNA kahjustusi parandada. Ka siin toimivad veaaltid DNA polümeraasid. DNA polümeraaside Y-perekonna ülesandeks on kahjustatud DNA ülesünteesimine (translesion DNA synthesis).
Ajalugu1927. aastal korraldas Hermann Muller katse, mille käigus kiiritati harilikku äädikakärbest röntgenikiirgusega. Selle katse põhjal järeldati, et röntgenikiirgus põhjustab fenotüübis silmaga nähtavaid muutusi. Muller tõestas selle katse abil oma hüpoteesi, et mutatsioonid põhjustavad vähki. Lewis Stadler demonstreeris röntgenikiirguse mutageenset toimet odral 1928. aastal ja ultraviolettkiirguse (UV) mutageenset toimet maisil 1936. aastal. 1940. aastal avastasid Charlotte Auerbach ja J. M. Robson, et ipriit võib põhjustada mutatsioone harilikul äädikakärbsel.
Spontaanne mutageneesSpontaansed ehk iseeneslikud mutatsioonid tekivad juhul, kui DNA polümeraas teeb DNA replikatsioonil vigu ilma väliste DNA-d kahjustavate tegurite osaluseta. Replikatsioonivead võivad tekkida järgmistel viisidel:
Kui tekkinud vigu DNA ahelast ei eemaldata ega parandata, kinnistuvad vead järgmises DNA replikatsioonitsüklis mutatsioonidena.
Punktmutatsioonid
Punktmutatsioonid on ühe nukleotiidi asendusmutatsioonid. Asendusmutatsioonid jaotatakse transitsioonideks ja transversioonideks. Transitsioon on see, kui üks puriin asendatakse teise puriiniga (A ↔ G) või pürimidiin teise pürimidiiniga (C ↔ T). Transversiooni puhul asendatakse puriin pürimidiiniga või vastupidi (C/T ↔ A/G).
Punktmutatsioone võib jagada ka nende toime järgi:
- missenssmutatsioon, kus üks aminohape asendatakse teisega (missense mutation);
- nonsenssmutatsioon, kus tekib stoppkoodon (nonsense mutation);
- ei muudeta aminohapet (silent mutation).
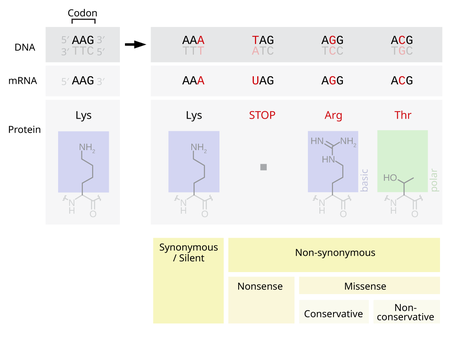
Illustratsioon punktmutatsioonide mehhanismist. Esimeses tulbas on normaalne järjestus. Teises tulbas on küll toimunud muudatus DNA järjestuses, aga selle järjestuse pealt sünteesitav valk jääb samaks. Kolmandal juhul põhjustab mutatsioon valgusünteesi lõpetamise. Viimasel kahel juhul viib mutatsioon DNA järjestuses muudatuseni sünteesitavas valgujärjestuses, sest ahelasse lülitatakse teistsugune aminohape.
Kromosomaalsed mutatsioonid
Kromosomaalsed mutatsioonid (chromosome aberration) on kromosomaalse struktuuri muutused. Need jagunevad deletsioonideks, duplikatsioonideks, inversioonideks ja translokatsioonideks. Kromosomaalsed mutatsioonid on üldjuhul kahjulikud ja nende tekkimisega võib kaasneda organismi surm. Samas on nad olulised liigitekkes ja evolutsioonis laiemalt.
Deletsioon
Deletsioon on mutatsioon, mille tulemusena kaob osa kromosoomist. Deletsiooniga on seotud mõned geneetilised haigused (nt Wolfi-Hirschhorni sündroom).
Deletsioon võib tekkida järgnevatel viisidel:
- vead kromosomaalses ristsiirde (chromosomal crossover),
- DNA-ahela teatud piirkondade kadu translokatsiooni kaudu (translocation),
- katkestus ilma liitumiseta (breaking without rejoining),
- ebavõrdne ristsiire (unequal crossing over).
On olemas kaks deletsioonitüüpi:
- terminaalne deletsioon,
- interstitsiaalne deletsioon.
Terminaalses deletsioonis kaob osa kromosoomi otsast, kus on telomeerid, interstitsiaalses deletsioonis aga keskelt.
Mida ulatuslikum on deletsioon, seda suurem osa geneetilisest informatsioonist kaob ja seda tõsisemad on organismi häired. Suured deletsioonid on fataalsed.
Duplikatsioon

Skeem kromosoomist enne ja pärast duplikatsiooni
Duplikatsioon on mutatsioon, mille tulemusena kahekordistub osa kromosoomist. Duplikatsioone võivad põhjustada vead homoloogilises rekombinatsioonis või retrotransposoonid. Duplikatsioonid mängivad evolutsiooniprotsessides olulist rolli. Geeni teine koopia on vaba selektiivsest survest. See tähendab, et mutatsioonid geeni koopias ei avalda organismile kahjulikku mõju ja võivad selles geenis koguneda palju kiiremalt kui funktsionaalses geenis. Susumo Ohno kirjeldas seda teooriat oma raamatus "Evolution by gene duplication" (1970).
Inversioon
Inversioon on mutatsioon, mille tulemusena vahetuvad omavahel ühe ja sama kromosoomi piirkonnad. Inversiooni võib jagada paratsentriliseks ja peritsentriliseks inversiooniks. Paratsentrilise inversiooni puhul leiab inversioon aset tsentromeerist ühel pool, peritsentrilise inversiooni puhul aga mõlemal pool tsentromeeri.
Inversiooni käigus ei kao geneetiline materjal ja inverteeritud kromosoom ei avalda fenotüübile mõju. Kui aga inverteeritud heterosügoodis toimub ristsiire, siis võib tekkida anomaalne kromatiid.
Inimesel on kõige rohkem levinud üheksandas kromosoomis tekkinud inversioon, mis ei ole kahjulik. Samas on andmeid, et naistel, kes kannavad seda inversiooni, on nurisünnituse tõenäosus 30%.
Translokatsioon
Kromosomaalne translokatsioon on mutatsioon, mille tulemusena toimub ümberkorraldus mittehomoloogsete kromosoomide vahel. Translokatsioone on võimalik jagada järgnevalt:
- vastastikune (non-Robertsonian) translokatsioon;
- Robertsoni (Robertsonian) translokatsioon.
Translokatsioonid võivad olla tasakaalustatud ja tasakaalustamata. Tasakaalustatud translokatsiooni puhul vahetub võrdne osa geneetilisest materjalist, tasakaalustamata translokatsiooni korral ebavõrdne osa.
Vastastikune translokatsioon on geneetilise materjali vahetus mittehomoloogsete kromosoomide vahel, kusjuures mõlemad kromosoomid jäävad alles. Selle tekkesagedus varieerub 1/500 kuni 1/625 vastsündinu kohta. Sellised mutatsioonid on enamikul juhtudest ohutud. Inimestel, kes kannavad tasakaalustatud vastastikuseid translokatsioone, võivad tekkida tasakaalustamata translokatsioone sisaldavad gameedid. Sellised gameedid põhjustavad laste väärarenguid. Enamik kandjatest on terved, aga umbes 6% nendest võivad olla autistid või kannatada arenguhäirete all.
Robertsoni translokatsioon on kromosoomide ümberkorraldus. Inimese genoomis esineb see akrotsentrilistel kromosoomipaaridel (kromosoomid 13, 14, 15, 21 ja 22). See on mittevastastikune mutatsioon, mille tulemusena kahest akrotsentrilisest kromosoomist moodustub üks. Kandjad on fenotüübilt normaalsed, aga meioosis võib neil tekkida gameete, mis põhjustavad näiteks Downi sündroomi (kui tegemist on 21. ja 14. (15.) kromosoomide translokatsiooniga).
Aneuploidsus
Aneuploidsus on ebanormaalne kromosoomide arv. Lisa- või kadunud kromosoom on tavaline geneetiliste häirete põhjus. Aneuploidsus tekib raku jagunemisel, kui kromosoomid ei jaotu õigesti kahe raku vahel. Kõige sagedamini tekib inimesel kolmas lisakromosoom paarides 21, 18 ja 13. Erinevatel liikidel on erinev normaalne kromosoomide arv, seepärast on aneuploidsus liigispetsiifiline termin.
Eristatakse järgmiseid aneuploidsuse tüüpe:
Monosoomia on ühe kromosoomi puudumine karüotüübist. Inimese sugukromosoomide monosoomia põhjustab Turneri sündroomi.
Disoomia on ühe kromosoomi kahe koopia olemasolu. See on normaalne, kui tegemist on diploidse organismiga (näiteks inimene), triploidsetel organismidel on see aneuploidsuse ilming.
Trisoomia on lisakromosoomi esinemine. Üleliigne 21. kromosoom põhjustab Downi sündroomi. 18. kromosoomi trisoomia põhjustab Edwardsi sündroomi ning 13. kromosoomi trisoomia Patau sündroomi. Need on ainsad autosomaalsed trisoomiad, mida on elusalt sündinud inimestel leitud. Trisoomia võib esineda ka sugukromosoomide puhul (47,XXX; 47,XXY; 47,XYY).
Tetrasoomia ja pentasoomia on vastavalt nelja ja viie kromosoomikoopia esinemine genoomis. Väga harva esineb seda autosoomidel, mõnevõrra sagedamini sugukromosoomidel. Inimestel on leitud 48,XXXX; 49,XXXXX; 49,XXXXY ja 49,XYYYY karüotüüpe.
Indutseeritud mutageneesMutageneesi kasutatakse laboratoorse meetodina mutantsete tüvede loomiseks. Üldjuhul tekitatakse mutantseid tüvesid kahel eesmärgil:
- teatud geeni või valgu funktsiooni uurimiseks;
- tööstuses kasutatavate tüvede saamiseks.
Juhuslik mutagenees
Juhuslik mutagenees tähendab seda, et mutatsioon toimub juhuslikus kohas või kohtades. Efekti on võimalik saavutada UV-kiirguse või erinevate kemikaalide abil. Näiteks võib Escherichia coli't mõjutada UV-kiirgusega ja seejärel kasvatada agarsöötmel. Üles kasvanud kolooniad tuleb pärast külvata ümber rikassöötmesse ja minimaalsöötmesse. Spetsiifiliste toitevajadustega mutandid ei kasva minimaalsöötmes. Söötme koostist muutes saab tuvastada, milline toitaine on mutanttüvele vajalik.
Saitspetsiifiline mutagenees
Saitspetsiifiline mutagenees on meetod, mille abil tekitatakse mutatsioon DNA molekuli spetsiifilises kohas. See mutageneesi vorm eeldab muudetava molekuli nukleotiidse järjestuse teadmist.
Üldjuhul on vaja sünteesida praimer, mis oleks komplementaarne DNA molekuli piirkonnale, kus tahetakse tekitada mutatsioon. Mutatsioon võib olla kas punktmutatsioon, deletsioon või insertsioon. Praimer seondub spetsiifilise kohaga, mis asub tulevase mutatsiooni läheduses. DNA polümeraas sünteesib komplementaarseid ahelaid, kus tekib mutatsioon. Mutatsioonisaidiga DNA-ahel integreeritakse plasmiidi ja amplifitseeritakse. Pärast integreeritakse see bakteri genoomi ja toimub rekombinatsioon. Selle protsessi tulemusena saadakse mutantseid tüvesid.
Kunkeli meetod
1987. aastal esitlesid Kunkel ja kolleegid mutageneesi indutseerimise meetodit, mille eeliseks on vähenenud vajadus mutantide välja sorteerimiseks. Selleks kasutatakse mutanti, millel puudub kaks ensüümi: dUTPaas ja uratsiili deglükosidaas. dUTPaasi puudumine takistab dUTP lagunemist, uratsiili deglükosidaasi puudumine takistab uratsiili eemaldamist DNAst. Tulemusena sünteesitakse DNA-ahel, mis sisaldab ka uratsiili. Seda DNA-ahelat kasutatakse mutageneesiks. Selleks sünteesitakse komplementaarne ahel, mida pärast töödeldakse uratsiili deglükosidaasiga, mis eemaldab DNA-ahelast uratsiili, ja siis leelisega. Saavutatakse mutatsiooniga DNA-ahel.
PCR saitspetsiifiline mutagenees
Selles meetodis kasutatakse kindlat mutatsiooni sisaldavaid praimereid. Need amplifitseerivad mutantset DNAd, mida saab pärast ekstraheerida, kasutades elektroforeesi. Mutantne geen sisestatakse DNA molekulisse, kasutades rekombinatsiooni meetodit.