Molekulaarbioloogias mõistetakse kloneerimisvektori all ümberkorraldatud DNA molekuli, mille abil saab biotehnoloogilistel eesmärkidel transportida võõraid DNA lõike rakku. Kloneerimisvektorite abil saab uurida geenide funktsioone ja toota valke tööstuslikel eesmärkidel. Vektorit, mis sisaldab võõrast uuritavat DNA-d, nimetatakse rekombinantseks DNA-ks.
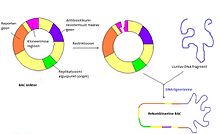
Viis tähtsaimat vektorit on plasmiidid, bakteriofaagid, kosmiidid, süstikvektorid ja kunstlikud kromosoomid, millest on enim kasutatud plasmiidid. Igal vektoril on kloneerimiseks vajalikud regioonid: multikloneerimisjärjestus, selektiivsusmarker, reportergeenid ja replikatsiooni alguspunktid.
Terminoloogia
Selektiivsusmarker
Selektiivsusmarker on kloneerimisvektoris olev geen (tavaliselt antibiootikumiresistentsust määrav geen), mis tagab peremeesraku kasvu kindlal söötmel. Kui näiteks vektoril on mõne penitsilliini resistentsusgeen, siis saab selle vektoriga rakk kasvada söötmel, millele on lisatud penitsilliini. Sellega tehakse kindlaks, et rakku on sisenenud õige vektor.
Reportergeenid
Tihti võib leida vektoritel reportergeene. Nende kaudu saab vektori olemasolu testida. Nende geenide katkestamine toob esile fenotüübilise muudatuse ja paljudel juhtudel sisestatakse uuritav DNA just reportergeeni sisse. Reportergeenis asub ka multikloneerimisjärjestus, mis lubab teha sinna lõikeid võõra DNA sisestamiseks.
Üheks reportergeeniks plasmiidses vektoris pBluescript II KS on lacZ geen, mille katkestamisel ei sünteesita enam β-galaktosidaasi. Kui söötmes on ühendit X-gal, siis katkestamata geeniga bakterikolooniad muutuvad siniseks ja katkestatud geeniga kolooniad valgeks. Selline värvil põhinev testsüsteem on sisenenud vektori kindlakstegemiseke tõhus viis.
Multikloneerimisjärjestus
Multikloneerimise asukoht on regioon vektoril, kuhu saab teha lõikeid uuritava geeni sisestamiseks. Tavaliselt on selleks regiooniks reportergeen, mille lõikamisel katkestatakse geeni funktsioon, mille järel on näha fenotüüpilisi muudatusi kolooniates. Lõigete tegemiseks kasutatakse restriktsiooniensüüme ja pärast vektori lahtilõikamist saab sisestada sinna uuritava geeni DNA ligeerimisega.
Replikatsiooni alguspunkt
Replikatsioon alguspunkt on selline piirkond vektoris, kust replikatsioon saab alata. Kloneerimisvektoris ei ole tavaliselt geene, mis tagaksid replikatsiooni. Selle eest vastutab bakteriraku kromosomaalne DNA, mis sünteesib vajalikke valke plasmiidi replikatsiooniks. See tagab uuritava geeni ekspressiooni vektoris.
Vektorid
Plasmiidid
Plasmiidid on kromosoomivälised, isereplitseeruvad DNA rõngasmolekulid bakteriraku sees, mis sisaldavad kasulikke geene peremeesrakule ja geene, mis lubavad sel säilida raku sees. Kui plasmiid aga bakterirakule kasulik ei ole, püüab bakter sellest loobuda ja selle tõttu on laborites kasvavad bakterid tavaliselt vähem elujõulised kui looduses elavad bakterid. Bakteriraku plasmiid ei ole automaatselt vektor. Selleks, et plasmiidist saaks vektor, tuleb seda laboritingimustes muuta. Plasmiidsete vektorite suurus võib varieeruda alates 1000 aluspaarist kuni 200 000 aluspaarini. Paljud plasmiidid sisaldavad antibiootikumiresistentsuse geene, mis on ideaalsed selektiivsusmarkerid.
Bakteriofaagid
Enamik viiruse vektoreid on sünteesitud lambda-nimelise bakteriofaagi kromosoomist. Viiruse genoomi saab lõigata lahti restriktsiooni ensüümidega ja seejärel in vitro sisestada sinna uuritav geen. Viirus siseneb seejärel rakku ja eraldab sinna oma vektori (viiruse genoomi, kuhu on sisse viidud uuritav geen), kust saab alata kloneerimine. Kloneerimise saaduse alusel saab teha edasisi uuringuid.
Kosmiidid
Kosmiidid on kunstlikult sünteesitud vektorid, millel on nii bakteriofaagi kui ka plasmiidi omadusi. Kosmiidid arendati välja suurte geenide (rohkem kui 150 000 aluspaari) kloneerimiseks, kuna plasmiidides ega viiruse vektorites nii suuri geene kloneerida ei saa. Kosmiididel on nii plasmiidide isereplitseerumise mehhanismid kui ka viiruse vektorite in vitro geeni sisestamise võimalusi.
Süstikvektorid
Kui plasmiidid, bakteriofaagid ja kosmiidid suudavad replitseeruda ainult bakterites, siis süstikvektorid on kunstlikult sünteesitud kloneermisvektorid, mis töötavad nii eükarüootsetes kui ka prokarüootsetes organismides. Süstikvekorid on väga kasulikud bakterite ja loomariigi vahelisteks geneetilisteks uuringuteks.
Kunstlikud kromosoomid
Kunstlikud kromosoomid on välja töötatud samuti väga suurte DNA regioonide uurimiseks. YAC (yeast artificial chromosomes) vektorid suudavad kanda endas kuni poole miljoni aluspaari suuruseid DNA segmente. YAC-e on kasutatud ka Inimese Genoomi Projektis, kus oli vaja kaardistada suuri genoomisegmente.
BAC-id (Bacterial artificial chromosomes) on sarnaselt YAC-idele suure DNA hoidmise mahuga. Erinevus on selles, et eükarüootsete organismide asemel kasutatakse neid bakterites.
Vektori kloneerimine
Selleks, et kasutada kloneerimisvektoreid, tuleb eelnevalt läbida mitu protsessi. Iga protsess viiakse läbi in vitro tingimustes ning kasutatakse mitut lahust. Esmalt tuleb uuritav DNA fragment restriktsiooniensüümidega lahti lõigata ja seda fragmenti polümeraasi ahelreaktsiooni meetodil paljundada. Seejärel tuleb lahti lõigata ka vektor ja uuritav geen ning vektor omavahel kokku ligeerida. Valminud rekombinantne DNA viiakse sisse peremeesrakku, kus rakk saab paljuneda koos vektoriga. Viimase etapina eraldatakse vektor ja seda kasutatakse vastavalt vajadusele. Lihtsuse mõttes kirjeldatakse järgnevates alapunktides plasmiidse DNA kloneerimist.
DNA fragmendi lõikamine
Uuritava DNA fragmendi lahtilõikamine algsest genoomist toimub restriktaaside kaudu. Restriktaasid on valgud, mis looduslikult kaitsevad rakke võõra DNA eest, tehes spetsiifilisi katkeid võõrasse sissetungivasse DNA-sse. Sellised restriktaasid tagavad rakule kaitse. Tänapäeval kasutavad restriktsiooniensüüme geneetikud DNA fragmentide kloneerimiseks. Restriktaase on palju ja igaüks neist lõikab ainult ühte kindlat järjestust DNA lõigul. Kui uuritava DNA järjestus on teada, saab ka kindlaks teha kohad, kust DNA-d lõigata, et uuritav lõik eraldada algsest genoomist.
Polümeraasi ahelreaktsioon
Kui uuritav DNA lõik on eraldatud, siis tuleb seda paljundada, et sooritada katseid, mis vajavad rohkem kui ühte DNA fragmenti. Paljundamiseks kasutatakse polümeraasi ahelreaktsiooni. See on laialdaselt kasutatav meetod DNA fragmentide paljundamiseks.
DNA ligeerimine
Selleks, et kloneerimisvektorisse uuritav DNA fragment sisestada, peab kõigepealt vektori restriktaasidega multikloneerimisjärjestuse alast lahti lõikama. Kui lahtilõigatud vektor ja uuritav DNA fragment kokku panna, peab need ligeerimisega kokku "kleepima". Selliseks kleepimiseks kasutatakse DNA ligaasi, mis liidab kokku fragmendi ja vektori.
Transformatsioon ja kompetentsed rakud
Protsess, mille käigus rakud võtavad endasse võõra geneetilise materjali, nimetatakse transformatsiooniks. Võõras DNA aga ei saa siseneda rakku ilma rakumembraanis toimuvate muutusteta. Selliseid meetodeid, kus rakumembraan muudetakse võõrale DNA-le vastuvõtlikuks, nimetatakse rakkude kompetentseteks muutmiseks. Laborites kasutatakse selleks tavaliselt rakkude töötlemist kahevalentsete katioonidega, näiteks Ca2+ (kaltsiumkloriid CaCl2). Kaltsiumkloriid laeb rakumembraani pinna positiivselt, mis lubab negatiivselt laetud DNA-l seonduda membraanile. Temperatuuri tõstmisega muudetakse membraan elastseks ja seejärel saab vektor rakku siseneda.
DNA replikatsioon
Selleks, et saada suurel hulgal sünteesitud kloneerimisvektoreid, tuleb rekombinantse DNA-ga rakke paljundada. Kui vektor on sisenenud rakku, hakkab vektor replitseeruma koos rakuga. Kuna kloneerimisvektor on olemuse poolest DNA, siis saab see paljuneda tavalise replikatsioonimehhanismi alusel. Selleks kasutab vektor peremeesraku enda nukleotiide ja polümeraase. Replikatsiooni tulemusena saadakse suur kogus kloneerimisvektoreid, mis on järgneva uurimistöö toormaterjaliks.
Plasmiidse DNA eraldamine bakterirakkudest
Plasmiidse DNA eraldamiseks on vaja algselt suurt kogust rakke. Selleks kasvatatakse plasmiidse DNA-ga rakke söötmes, kus on sees vektori selektiivsusmarkerile vastav antibiootikum. Vedelsöötmel kasvanud rakkudest saab eraldada plasmiidse DNA mitmel meetodil, kuid peamine on aluselise lüüsi meetod. Selle käigus lüüsitakse (purustatakse) rakud ning DNA denatureerub (sulab lahti). Aluselise lüüsi metoodikas kasutatakse pH muutuste mõju DNA-le. Kromosomaalne DNA ei jõua piisavalt kiiresti renatureeruda (tagasi ühineda) ja alles jääb ainult plasmiidne DNA. Seejärel tsentrifuugitakse valgud ja kromosomaalne DNA põhja ning lahusesse jääb ainult plasmiidne DNA. Edasi saab neid vektoreid sisestada teistesse organismidesse ja jälgida, kuidas sünteesitud vektor neid mõjutab.