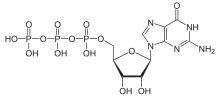
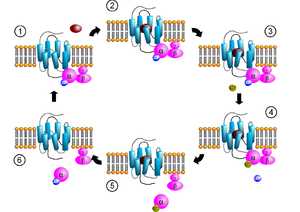
Ioonikanal ehk ioonkanal on transmembraanne valk, kus membraani läbivatest valgumolekulidest moodustub kanal ehk poor. Ioonikanalid aitavad tekitada ja kontrollida elektrilist gradienti läbi kõikide elusrakkude rakumembraani (vt puhkepotentsiaal), võimaldades ioonide liikumist mööda elektrokeemilist gradienti (näit närviimpulsi teke ja ülekanne).

Ioonikanal avaneb (näiteks ligandi toimel) ning laseb perioodiliselt ja väga valikuliselt läbi teatud ioonid või ühe või mitu aniooni või katiooni.
Üldiseloomustus
Kaks peamist omadust, mis eristavad ioonikanaleid teistest ioontransporteritest ehk ioonpumpadest:
- ioonikanalit läbivaid ioone on palju (miljon või enam iooni sekundis);[2]
- ioonid läbivad kanali mööda elektrilist gradienti, vajamata ATP kujul lisaenergiat ega mõnda muud mehhanismi.
Ioonikanalid paiknevad peaaegu kõikide elusorganismide rakkude rakumembraanides ja mitmes rakuorganellis. Valk moodustab kitsa ava läbi membraani, kust pääsevad läbi vaid kindla suuruse ja/või laenguga ioonid. Seda kutsutakse selektiivseks permeaabluseks ehk selektiivseks läbitavuseks. Tüüpiline ioonikanal on vaid ühe või kahe aatomi laiuse vahega oma kitsaimast kohast ning seda saavad läbivad vaid kindlat tüüpi ioonid, näiteks kaalium või naatrium. Mõned kanalid võivad olla aga läbitavad rohkem kui üht tüüpi ioonidele, kuid üldiselt peavad ioonid siiski sama laenguga olema: positiivsed katioonid või negatiivsed anioonid. Ioonid liiguvad läbi kanali üksteise järel tihti sama kiiresti kui mujal lahuses. Mitme iooni läbitavust reguleeritakse värava ehk tõkkega, mis avaneb ja sulgub reaktsioonina keemilisele või elektrilisele signaalile, temperatuurile või mehaanilisele jõule.
Ioonikanalid on integraalsed membraanivalgud, koosnedes tavaliselt mitmest valgust. Eri alaühikud ehk subühikud on tavaliselt homoloogilised või identsed ning paiknevad ringikujuliselt tihedalt üksteise kõrval, omavahel membraani läbivat poori moodustades. Pingeseoseliste ioonikanalite poori moodustavaid alaühikuid kutsutakse α alaühikuteks ning abistavaid alaühikuid tähistatakse β, γ jne.
Bioloogiline roll
Ioonide reguleeritud ja selektiivne transport, mis toimub ioonikanalite kaudu, on aluseks mitmele fundamentaalsele füsioloogilisele protsessile. See hõlmab näiteks elektrisignaale südames ja närvisüsteemis, neerude tööd ja immuunvastust. Palju toksiine on välja arenenud halvamaks saaklooma närvisüsteemi ioonikanaleid (näiteks ämblike ja madude mürgid). Need töötavad, muutes ioonikanali juhtivust ja/või kineetikat. Ioonikanalid on ka võtmeosaks mitmes bioloogilises protsessis, mis vajavad kiireid muutusi rakkudes, näiteks südame-, skeleti- ja silelihaste kokkutõmbed, epiteelkoes toitainete ja ioonide transport, T-lümfotsüütide aktivatsioon ja pankreases insuliini vabastamine. Uute ravimite väljatöötamisel üritatakse mõjutada just ioonikanalite tööd. Ioonikanalite olulisust näitab ka see, et nad moodustavad tervelt 1,5% inimgenoomist.
Teatud tüüpi kanalite alaühiku(te) puudumine või mutatsioon neis võib viia funktsiooni kadumiseni ja on põhjuseks mitmele neuroloogilisele ja teistele haigustele.
Mitmekesisus
Elusrakkudes on üle 300 tüübi ioonikanaleid. Vastavalt läbilastavate ioonide laengule saab neid jagada katioonikanaliteks ja anioonikanaliteks. Veel saab neid jagada lekkivateks(ingl leakage) kanaliteks, mis on pidevalt avatud ja tõkestatavateks (ingl gated) kanaliteks, mida saab avada ja sulgeda vastava ligandi või muu mehhanismi abil. Kanaleid võib kategoriseerida ka tööpõhimõtte, arvu või valkude paiknemise järgi.
Ioonikanaleid saab edasi eristada, kui abistavad alaühikud tekitavad spetsiifilist tüüpi voolu.
Klassifikatsioon tõkestuse järgi
Ioonikanaleid saab klassifitseerida tõkestatuse (ingl gating) järgi, mis avab ja sulgeb kanali. Pingeseoselised ehk pingetõkestatud ioonikanalid avanevad ja sulguvad vastavalt plasmamembraani pingegradiendile, samas ligandseoselised ioonikanalid avanevad ja sulguvad vastava ligandi seondumisel kanalile.
Pingeseoselised ioonikanalid
Rakumembraanil paiknev potentsiaalide erinevuse tekitatud elektriväli põhjustab ioonikanalis konformatsioonilisi muutusi, mis vastavalt membraanipotentsiaalile avavad või sulgevad pingeseoselise ioonikanali.
- Pingeseoselised naatriumkanalid: pere sisaldab 9 liiget ja vastutab närviimpulsside tekkimise ja levimise eest. Poori moodustav α alaühik on suur ja koosneb neljast homoloogilisest kordusdomeenist. Kanal koosneb ka abistavast β alaühikust. Mõlemad alaühikud on tugevalt glükosüülitud.
- Pingeseoselised kaltsiumkanalid: pere sisaldab 10 liiget ja nad koosnevad α2δ, β ja γ alaühikutest. Kanalid on olulised nii lihasrakkude kokkutõmmetel, ergastamisel kui ka närvirakkude ergastamisel koos virgatsaine vabastamisega.
- Pingeseoselised kaaliumkanalid: pere koosneb umbes 40 liikmest, mis jagunevad omakorda 12 alaüksuseks. Peamiselt on need kanalid tuntud selle tõttu, et nad repolariseerivad rakumembraani pärast närviimpulssi. α alaühikud, millel on 6 membraani läbivat segmenti, moodustavad tetrameere loomaks funktsioneerivat kanalit.
- Mööduva retseptorpotentsiaaliga kanalid: perekonnaliikmeid on vähemalt 28 ning neid nimetatakse TRP (ingl transient receptor potential) kanaliteks. See rühm kanaleid on väga mitmekesiste aktivatsioonimeetoditega. Mõned kanalid võivad olla konstitutiivselt avatud, samas teiste avatust reguleerivad pinge, rakusisene Ca2+, pH, reduktsiooniaste, osmolaarsus ja mehaaniline venitamine. Kanalid erinevad ka ioonide poolest, mida nad läbi lasevad. Mõned on selektiivselt Ca2+ kanalid, teised on vähem selektiivsed, funktsioneerides katioonikanalitena.
- Hüperpolarisatsioon-aktiveeritud tsükliliste nukleotiidide tõkestatavad kanalid: kanalid avanevad hüperpolarisatsiooni mõjul, erinevalt teistest tsükliliste nukleotiidide tõkestatavatest kanalitest, mis avanevad depolarisatsiooni mõjul. Need kanalid on tundlikud tsüklilistele nukleotiididele cGMP (tsükliline guanosiinmonofosfaat) ja cAMP, mis mõjutavad kanali avanemise pingetundlikkust. Kanal on läbitav monovalentsetele K+ ja Na+ katioonidele. Peres on 4 liiget, millest kõik moodustavad tetrameere kuuekordselt membraani läbivatest α alaühikutest. Kuna kanalid avanevad hüperpolarisatsiooni tingimustes, funktsioneerivad nad südame rütmi hoidvate rakkude töös.
- Pingeseoselised prootonkanalid: kanalid avanevad depolarisatsioonil, aga on tugevalt pH-sõltuvad. Tulemusena avanevad kanalid vaid juhul, kui elektrokeemiline gradient on väljapoole (tsütoplasmas on positiivsem laeng kui väljaspool rakku), mille toimel liiguvad ainult prootonid rakust välja. Sellest tulenevalt on nende funktsioon happe väljutamine rakust. Veel on need kanalid kasutuses fagotsüütides oksüdatiivse purske ajal. Kui fagotsüüt on neelanud mikroobi, siis ensüüm NADPH oksüdaas koondub membraani ja hakkab tootma reaktiivseid hapnikuühendeid, mis aitavad mikroobe surmata.
Ligandseoselised kanalid
Ligandseoselist ehk ligandtõkestatud rühma tuntakse ka kui ionotroopseid retseptoreid. Kanalid avanevad kindla ligandmolekuli seondumisel rakuvälisele retseptorvalgu domeenile. Ligandi seondumine põhjustab konformatsioonilisi muutusi kanalivalgu struktuuris, mis viib kanali avanemiseni. Sellele järgneb ioonide vool läbi plasmamembraani. Sellised kanalid on näiteks katioone läbilaskev nikotiinergiline atsetüülkoliini retseptor, ionotroopsed glutamaat-tõkestatud retseptorid, happetundlikud ioonikanalid (ASIC – acid-sensing ion channel) ja ATP-tõkestatud P2X retseptorid.
Teiste tegurite toimel avanevad kanalid
See kategooria hõlmab muuhulgas sekundaarset edastajate aktivatsiooni ja inaktivatsiooni. Nende signaal pärineb raku seest. Võrdluseks, ligandtõkestatavatel kanalitel tuleb taoline signaal väljastpoolt rakku. Sellisteks sekundaarseteks edastajateks võivad olla ioonid, mis põhjustavad kanali otsest aktivatsiooni. See erineb pingeseoseliste ioonikanalite kaudsest aktivatsioonist (ioonidest tekkinud elektriline potentsiaal põhjustab (in)aktivatsiooni).
- Mõned kaaliumkanalid:
- kaltsium-aktiveeritud kaaliumkanalid: pere 8 liiget aktiveerib peamiselt rakusisene Ca2+;
- kahe poori domeeniga kaaliumkanalid: enam kui 15 liikmest koosneva pere kanalid võivad olla aktiveeritavad kindlate lipiidide, lenduvate anesteetikumide, kuumuse, hapniku, prootonite või membraanipingega.
- Valgustõkestatavad kanalid avanevad valguse toimel. Näiteks üherakulistel vetikatel on kanalrodopsiin, mis osaleb valguse aistimises ja valgusele reageerimises.
- Mehaanilise pinge tundlikud ioonikanalid (MSC – mechanosensitive channels) avanevad ja sulguvad venimise, rebenemise, rõhumuutuse ja nihke (ingl displacement) tulemusel. Mikroorganismides on see kasutuses sensoorse andurina rakusuuruse reguleerimiseks. Nende funktsionaalset tähtsust näitab ka fakt, et E. coli'l on 5 erinevat MSC-d.
- Tsükliliste nukleotiidide tõkestatavad ioonikanalid.
- Temperatuurtõkestatud ioonikanalid avanevad reaktsioonina külmale või soojale temperatuurile. Näiteks TRPV1 avaneb, kui temperatuur tõuseb paar kraadi üle 35 °C, ja TRPM8 avaneb järsult, kui temperatuur langeb alla 25 °C.
Klassifikatsioon paiknemise järgi
Ioonikanalid võivad asuda nii rakku ümbritseval plasmamembraanil kui ka rakusiseste organellide membraanil. Kuna plasmamembraan moodustab vaid ~2% tervest raku membraanist, siis ülejäänud 98% on rakusiseste organellide koostises (nt endoplasmaatiline retiikulum, Golgi kompleks, mitokonder ja kloroplast). Selle alusel jagatakse ioonikanalid kaheks:
- Plasmamembraani kanalid paiknevad raku plasmamembraanis.
- Rakusisesed kanalid, mida klassifitseeritakse organellide järgi.
- Endoplasmaatilise retiikulumi kanalid: sealhulgas RyR, SERCA, ORAi, IP3R, PERK.
- Mitokondri kanalid: sealhulgas mPTP, KATP, BK, IK, CLIC5 ja Kv7.4k, mis paiknevad sisemisel membraanil, ning välimise membraani kanalid VDAC ja CLIC.
- Kloroplasti kanalid: tülakoidi ioonikanalid.
Ioonikanali blokeerijad
Paljud anorgaanilised ja orgaanilised molekulid võivad muuta ioonikanali aktiivsust ja juhtivust. Levinumad ioonikanalite blokaatorid on näiteks:
tetrodotoksiin (TTX) – toksiin, mida kasutab kerakala enesekaitseks, blokeerides ohvri naatriumkanaleid;
saksitoksiin (STX) – neurotoksiin, mida looduslikult toodavad paljud dinoflagellaadid ja tsüanobakterid, mis blokeerib pingeseoselisi naatriumkanaleid;
konotoksiin – neurotoksiline valk, mida toodab koonustigu. Eri tüübid võivad mõjutada näiteks naatriumkanaleid, kaaliumkanaleid ning pingeseoselisi naatrium- ja kaltsiumkanaleid;
lidokaiin ja novokaiin – kasutatakse lokaalanesteetikumidena näiteks hambaravis, blokeerivad naatriumkanaleid;
dendrotoksiinid – klass presünaptilisi neurotoksiine, mida toodavad mambad, blokeerivad teatud alamtüüpe pingeseoselisi kaaliumkanaleid. Musta mamba toodetud dendrotoksiin K blokeerib eelistatult Kv1.1 kanaleid ja on aktiivne juba pikomolaarsetel kontsentratsioonidel.
Patoloogia
Loomadel (sh inimestel) seostatakse ioonikanalitega hulka haiguslikke seisundeid, nagu kaasasündinud hüperinsulism, tsüstneer, tsüstiline fibroos, Brugada sündroom, mukolipidoos IV.
Tsüstilist fibroosi põhjustab ka mutatsioon CFTR-geenis, mis kodeerib tsüstilise fibroosi transmembraanse juhtivuse regulaatorvalku (CFTR), mis on kloriidikanal. Mutatsioon selles geenis häirib kloriidiooni transporti rakust välja. Haiguse korral kattuvad kopsud seest limaga, peamine sümptom on hingamishäired. Kahjustada saavad ka maks, pankreas ja seedesüsteem.
Brugada sündroomi põhjustavad mutatsioonid pingeseoselises naatriumkanalis. Sümptomiteks on ventrikulaarne arütmia, sünkoop ja südameseiskumine, mis leiavad aset peamiselt kas magades või puhates. On täheldatud ka eelnevate sümptomiteta südame äkksurma.
Mukolipidoos IV põhjustavad mutatsioonid TRMPML1 kanalit kodeerivas geenis. Sümptomiteks on arengu mahajäämus ja progresseeruv nägemiskahjustus.
Närvisüsteemi haigustest seostatakse eri ioonikanalite düsfunktsiooniga epilepsiat, episoodilist ataksiat, auraga migreeni, Eatoni-Lamberti sündroomi, Alzheimeri tõbe, Parkinsoni tõbe, skisofreeniat, ekstrapüramidaal- ja liigutushäireid, müotoonilisi haigusseisundeid jpt.
Episoodilise ataksia tüübid 1 ja 2: esimest tüüpi põhjustavad mutatsioonid KCNA1 geenis, mis kodeerib pingeseoselist kaaliumkanalit KV1.1. Teist tüüpi põhjustavad mutatsioonid CACNA1A geenis, mis kodeerib pingeseoselist kaltsiumkanalit.