Otsing sellest blogist
UUS!!!
Malaaria
Malaaria ehk halltõbi on transmissiivsete haiguste rühm, mida põhjustavad punalibledesse elama asunud eukarüootsed algloomad per...
teisipäev, 1. august 2023
GENEETIKA: Monohübriidne ristamine
esmaspäev, 31. juuli 2023
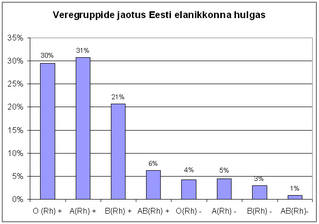
GENEETIKA: Vererühmade pärandumine
Alleelid IA ja IB domineerivad alleeli i üle! IA ja IB on omavahel kodominantses suhtes. Vererühm on polüalleelse tunnuse näide (populastioonis üle kahe sama geeni alleeli). I on dominantne alleel ja i on retsessiivne alleel. Dominantsed tunnused avalduvad alati. Retsessiivne tunnus avaldub ainult juhul kui kokku saavad kaks retsessiivset alleeli.
Ülesandeid:
reede, 28. juuli 2023
Modifikatsiooniline muutlikkus
neljapäev, 27. juuli 2023
Mendeli hübridiseerimiskatses ilmnenud seaduspärasused
Sissejuhatus
Tänapäeval ei kujutaks me ette geneetikat ilma DNA uuringuteta. Geneetilised uuringud on muutunud nii lihtsaks ja kättesaadavaks, et igal inimesel on võimalik saata enda DNA laborisse, et saada rohkem teada oma päritolu kohta või uurida pärilike haiguste eelsoodumuse kohta. Kuid kas teadsite, et geenide pärandumise seaduspärad avastati ligikaudu sada aastat enne seda, kui mõisteti DNA rolli päriliku info salvestamisel?
Õpieesmärgid
Selle peatüki lõpuks:
- kirjeldate Mendeli katsetes ilmnenud seaduspärasid;
- seostate Mendeli katsetes ilmnenud seaduspärasid nende geneetilise põhjendusega;
- lahendate Mendeli seadustel põhinevaid ülesandeid;
- selgitate Mendeli seaduste rakendusvõimalusi.
Mendeli katsed
Esimesed avastused pärilikkuse seaduspärade kohta tegi Tšehhi munk ja kooliõpetaja Gregor Mendel juba 19. sajandi keskel. Enne Mendeli avastusi usuti, et vanemate tunnused segunevad järglastes sarnaselt nagu sinine ja kollane värv annavad segades rohelise. Mendel arvas seevastu, et pärilikkus tuleneb teatud muutumatute pärilikkusüksuste edasi andmisest. Tema teooria kohaselt on organismis igast tunnusest kaks versiooni, mille organism saab oma vanematelt. Oma teooria katsetamiseks ristas ta kloostriaias herneid ning uuris tunnuste pärandumist (joonis 3.3.5.1.). Pärilikkuse uurimist selliste meetoditega, mida kasutati enne DNA rolli avastamist, nimetatakse tänapäeval klassikaliseks geneetikaks.
![Gregor Mendel. By Bateson, William (Mendel's Principles of Heredity: A Defence) [Public domain], via Wikimedia Commons Pilt: Gregor Mendel](https://vara.e-koolikott.ee/sites/default/files/h5p/content/12782/images/collageClip-5b604dfbe8497.jpg)

Joonis 3.3.5.1. Gregor Mendel selgitas hernetaimi kasvatades ja uurides välja põhilised tunnuste pärandumise seaduspärad.
Mendeli katsed hernestega
Mendel uuris oma katsetes seitsme tunnuse pärandumist: herneseemnete värv ja kuju, kauna värv ja kuju, õite värv ja asetus ning taime kasv. Esialgu ristas ta taimi, mis erinesid omavahel ainult ühe tunnuse poolest. Esmalt kasvatas ta eri tunnustega taimi eraldi peenardel. Seeläbi selgitas ta välja, et ühest puhtast sordist taimed annavad alati täpselt samasuguseid järglasi, näiteks rohelise herne taimedelt saab alati roheliste seemnetega järglasi (joonis 3.3.5.2.).
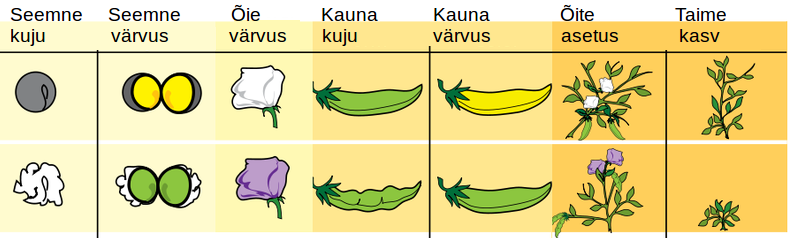
Joonis 3.3.5.2. Mendel ristas erinevate tunnustega herneid ning uuris tunnuste pärandumist.
Seejärel ristas Mendel omavahel erinevaid hernesorte, näiteks kollaseid herneid rohelistega. Katse tulemusena selgus, et igast tunnuste paarist leidus üks domineeriv tunnus, mis pärast ristamist saadud järglastes avaldus. Puhtasse sorti kuuluvate kollaste ja roheliste herneste ristamisel saadi ainult kollaseid herneid, krobelisi ja siledaid herneid ristates oli tulemuseks aga vaid siledad herned (joonis 3.3.5.3.).

Joonis 3.3.5.3. Mendel avastas oma katsete käigus, et igas tunnustepaaris leidus üks domineeriv tunnus.
Ristates esimese järglaste põlvkonna herneid omavahel sai Mendel aga hoopis teistsugused tulemused. Roheliste ja kollaste herneste ristamisel saadud kollaseid herneid omavahel uuesti ristates olid järglastest ¾ kollased ning ¼ rohelised (joonis 3.3.5.4.). Sarnased osakaalud olid iseloomulikud kõigi vaadeldud tunnuste puhul. Sellest järeldas Mendel, et teises põlvkonnas tunnused lahknevad uuesti.
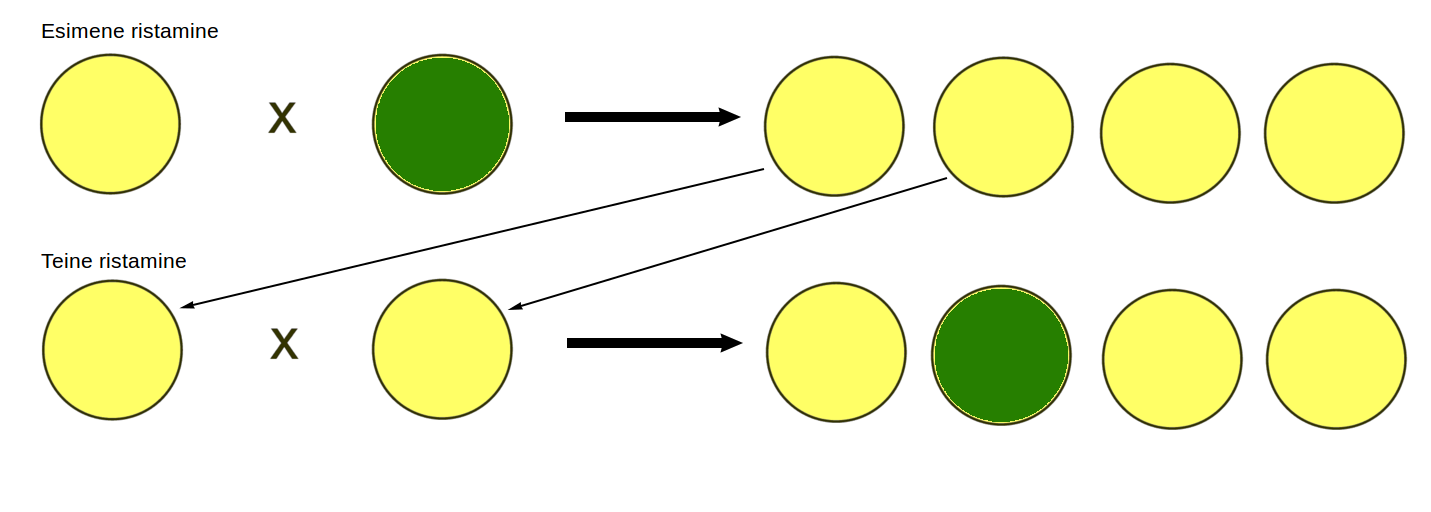
Joonis 3.3.5.4. Kollaste ja roheliste herneste ristamisel saadud järglased on kõik ühetaoliselt kollased. Saadud kollaseid herneid omavahel ristates lahknevad tunnused uuesti ning 1/4 saadud hernestest on rohelised.
Simulatsiooni abil saate ka ise Mendeli katseid läbi viia proovida. Selleks vajutage esmalt "Breed" ehk rista, et luua kaks juhuslikku vanemat, ja uuesti "Breed", et näha nende vanemate järglasi. Seejärel valige kaks järglast, keda soovite omavahel ristata, ning vajutage taaskord "Breed", et näha järgmise põlvkonna järglasi. Saate protsessi korrata nii mitu korda kui soovite, kuid 6 põlvkonna järel hakkavad vanemad põlvkonnad kaduma. Kui soovite alustada simulatsiooni uuesti uute juhuslike vanematega, siis uuendage lehte või sulgege see ja avage uuesti. Kas oskate simulatsiooni abiga leida samad seaduspärad, mis Mendel oma katsetega tuvastas?
Mendeli seadused
Tänapäeval saame Mendeli avastusi põhjendada teadmistega geenide toimimisest. Teame, et organismi keharakkudes on kahekordne kromosoomistik ning igast geenist on kaks versiooni, millest üks pärineb emalt, teine isalt. Selliseid geenide versioone nimetatakse alleelideks. Kui organismil on mingi geeni mõlemad alleelid ühesugused, nimetatakse seda homosügootsuseks, kui erinevad, siis heterosügootsuseks. Mendeli esimesed katsed olid sordipuhaste taimedega, mis andsid ainult ühesuguste tunnustega järglasi, järelikult oli seal tegemist homosügootsete ehk samasuguste alleelidega taimedega.
Erinevate tunnustega organismide ristamise tulemusi on kõige parem selgitada skeemi abil. Kokkuleppeliselt tähistatakse sellisel skeemil puhtast sordist vanemaid tähega P (ladina keeles parentes ehk vanemad) ning nende järglasi tähega F (ladina keeles filii ehk lapsed). Seda, mitmenda põlvkonna järglastega on tegemist, tähistatakse numbriga, näiteks F1 ja F2.
Mendeli järgmistes katsetes oli erinevateks alleelideks näiteks seemne kollane või roheline värvus. Tähistades kollast värvust määrava alleeli A tähega ning rohelist värvust määrava alleeli a tähega, ilmneb, et puhtast sordist kollaste herneste alleelid on AA ja roheliste herneste alleelid aa (joonis 3.3.5.5.). Sugurakkude valmimisel jääb igasse sugurakku üks alleel. See tähendab, et kollaste herneste sugurakkudesse jäävad alleelid A ja A, roheliste herneste sugurakkudesse a ja a. Kollase ja rohelise herne sugurakkude liitumisel on seega ainsad võimalikud kombinatsioonid, mis saavad tekkida, Aa, ehk hernes, kus on üks kollast ning üks rohelist värvust määrav alleel.

Joonis 3.3.5.5. Kollaste ja roheliste puhtast sordist herneste ristamisel on tulemuseks herned, millel on üks kollast, üks rohelist värvust määrav geenivariant. Kuna kollane on domineeriv tunnus, siis on välimuselt kõik herned kollased.
Hoolimata sellest, et kõigil F1 põlvkonna hernestel on mõlemad alleelid, on kõik herned väliselt ühetaolised ehk kollased. Järelikult avaldab värvusele mõju ainult üks alleelidest. Seda alleeli, mis ristamise järel avaldub, nimetatakse dominantseks alleeliks, ja teist alleeli nimetatakse retsessiivseks. F1 põlvkonna järglastel on kõigil üks dominantne ja üks retsessiivne alleel ehk nad on heterosügootsed ning kõik järglased on omavahel identsed. Seda järeldust nimetatakse Mendeli esimeseks seaduseks.
Vaatame nüüd skeemil, mis juhtub, kui ristata omavahel F1 põlvkonna heterosügootseid järglasi, kellel on Aa alleelid ehk üks kollast, teine rohelist värvust määrav alleel. Sugurakkude valmimisel jääb kummalgi hernel osadesse sugurakkudesse kollast (A) ja teistesse rohelist (a) värvust määrav alleel. Ühe taime sugurakud liituvad teise taime sugurakkudega, järelikult on uues ehk F2 põlvkonnas võimalik kolm erinevat kombinatsiooni: AA, Aa ning aa (joonis 3.3.5.6.). Kuna domineeriv tunnus ehk kollane värvus avaldub nii AA kui ka Aa kombinatsiooni korral, retsessiivne tunnus ehk roheline värvus aga vaid aa kombinatsiooni korral, on lihtne näha, miks ¾ järglastest on domineeriva ning ¼ retsessiivse tunnusega. Nende tulemuste põhjal on sõnastatud Mendeli teine seadus: F2 põlvkonnas lahknevad tunnused kindlates suhetes.
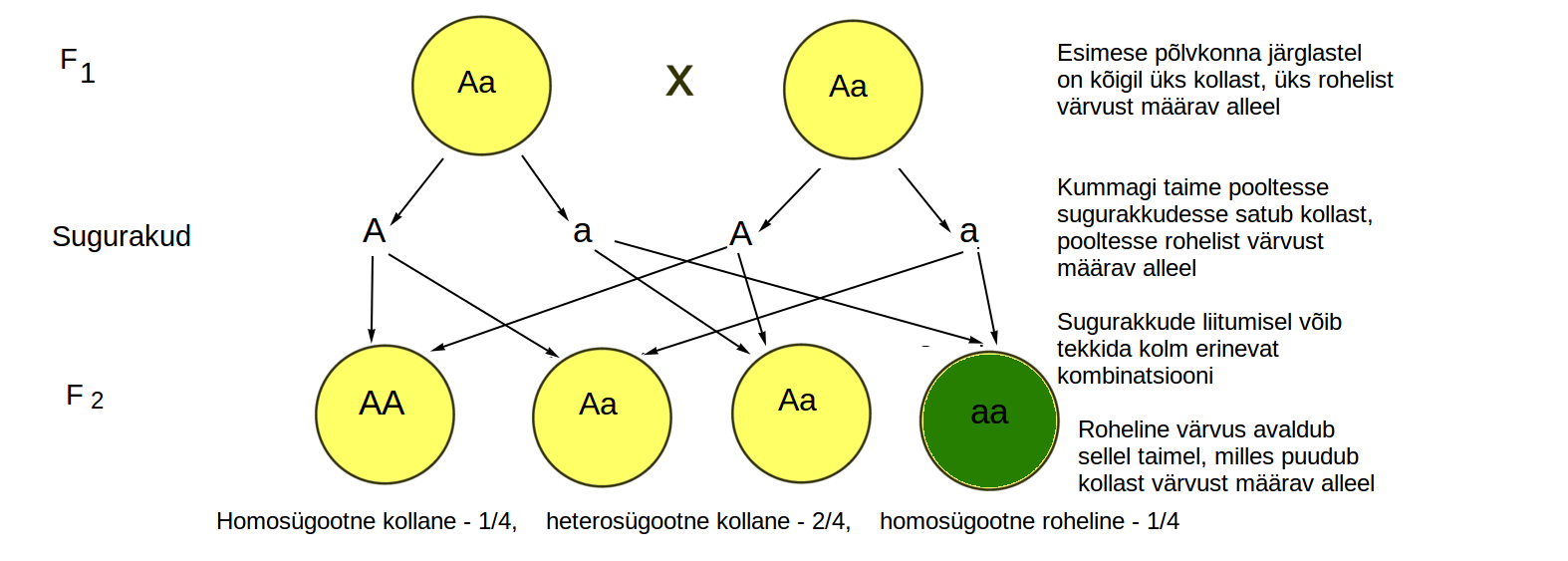
Joonis 3.3.5.6. F1 põlvkonna ristamisel omavahel lahknevad tunnused kindlas vahekorras. 3/4 järglastest avaldub dominantne tunnus ning 1/4 retsessiivne tunnus.
Uurides mitme erineva tunnusega herneste lahknemist järeldas Mendel ka seda, et tunnused päranduvad üksteisest sõltumatult. Seda seaduspära nimetatakse Mendeli kolmandaks seaduseks. Tänapäeval teame, et see seadus kehtib ainult tunnuste puhul, mida määravad geenid asuvad erinevates kromosoomides või samas kromosoomis, kuid üksteisest kaugel. Lähedal asuvad geenid päranduvad koos, kuna need antakse sama kromosoomiga järglastele edasi. Seetõttu avalduvad osad tunnused enamasti koos.
Mendeli seaduste rakendusvõimalused
Kuigi Mendeli katsed tuginesid herneste sihipärasele ristamisele, on tema avastatud seadustel palju laiem rakendus. Mendeli seadused kehtivad ka looduses juhuslikult sündivate järglaste puhul, sealhulgas inimestel. Samas tuleb silmas pidada, et mitte kõik tunnused ei pärandu vastavalt Mendeli seadustele. Inimestel on puhtaid Mendeli seaduste kohaselt päranduvaid tunnuseid küllaltki vähe. Paljud tunnustest on määratud mitme geeni poolt. Selliseid tunnuseid nimetatakse polügeenseteks. Polügeensed tunnused on näiteks silmade värv, kasv, kehakaal ja nahavärv (joonis 3.3.5.7.).

![Silmavärv on polügeenne tunnus. [CC-0 https://pixabay.com/photos/eye-color-iris-view-human-229957/] Pilt: silmavärv](https://vara.e-koolikott.ee/sites/default/files/h5p/content/12782/images/collageClip-5b60698690c7d.jpg)
Joonis 3.3.5.7. Kasv ja silmavärv on polügeensed tunnused ehk nende tunnuste määramisel osaleb rohkem kui üks geen.
Enamikul tunnustest ei suru üks alleel teist täielikult maha. Olukorda, kus heterosügoodil avaldub kahe homosügoodi vahepealne tunnus, nimetatakse intermediaarsuseks. Näiteks saab sageli punaste ja valgete õitega lillede ristamisel roosade õitega järglased. Mõnikord võivad aga mõlema alleeli poolt määratud tunnused avalduda samaaegselt. Seda nimetatakse kodominantsuseks ning siis saadakse punaste ja valgete õitega lillede ristamisel hoopis punase-valge-kirjud lilled (joonis 3.3.5.8.).
![Kodominantsus [CC-0] Pilt: punase-valgekirjud õied, näide kodominantsusest](https://vara.e-koolikott.ee/sites/default/files/h5p/content/12782/images/collageClip-5b606b7484f3a.jpg)
![Kodominantsus [CC-0] Pilt: punase-valgekirjud õied, näide kodominantsusest](https://vara.e-koolikott.ee/sites/default/files/h5p/content/12782/images/collageClip-5b606b807823c.jpg)

Joonis 3.3.5.8. Kui punaste ja valgete õitega taimede ristamisel saadakse roosade õitega taim, on tegemist intermediaarsusega, kui aga punase-valgekirjud õied, siis kodominantsusega.
Mendeli seadused on siiski olulised, kuna võimaldavad leida mitmete haiguste, näiteks daltonismi ehk punarohepimeduse (joonis 3.3.5.9.) ja hemofiilia ehk vere hüübimatuse esinemise tõenäosust järglastel. Selleks on vaja teada, kas vanemad on selle tunnuse suhtes homo- või heterosügootsed. Katseloomade- ja taimede puhul ristatakse selleks dominantsete tunnustega isendit retsessiivsete tunnustega isendiga. Kui järglased on kõik ühesugused, on tegemist homosügootsusega, kui aga toimub lahknemine suhtes 1:3, siis on tegemist heterosügootse vanemaga. Inimeste puhul loomulikult selliseid meetodeid kasutada ei saa, seetõttu tuleb lasta DNA-d analüüsida või uurida oma sugupuud.

Joonis 3.3.5.9. Daltonismi ehk puna-rohe-pimesuse korral ei suuda inimene eristada punaseid ja rohelisi toone. Sellisel juhul ei ole inimene võimeline pildil olevat numbrit lugema.
Kokkuvõte
Keharakkudes on igast geenist kaks versiooni ehk alleeli, mis mõjutavad tunnuse avaldumist. Dominatne tunnus avaldub ka heterosügootidel, retsessiivne tunnus ainult homosügootidel. Mendeli seaduste kohaselt päranduvad tunnused üksteisest sõltumatult ning kindla seaduspärasuse alusel. Homosügootsete vanemate ristamisel on F1 põlvkonna järglased kõik heterosügootsed ning ühetaolised, F2 põlvkonna järglastel toimub aga tunnuste lahknemine. Kõik tunnused ei pärandu Mendeli seaduste kohaselt, kuid Mendeli seaduste tundmine aitab mõista mitmete haiguste pärandumist ning arvutada haigete järglaste saamise tõenäosust.
Mõisted
alleel
homosügootsus
heterosügootsus
dominantsus
retsessiivsus
polügeensus
intermediaarsus
kodominantsus
kolmapäev, 26. juuli 2023
CRISPR-Cas9 süsteem
CRISPR-Cas9 süsteem
CRISPR-Cas9 süsteem on prokarüootide immuunsüsteemi osa, mis annab resistentsuse mitteomaste geneetiliste elementide, näiteks plasmiidide või faagide suhtes. Selle süsteemi kasutamine biotehnoloogias võimaldab väga kiirelt, täpselt ja odavalt DNA-d muuta ning seepärast peetakse selle avastamist ja kasutuselevõttu üheks suuremaks revolutsiooniks selles valdkonnas.[1][2]
See omandatud immuunsüsteem koosneb CRISPR-kordusjärjestustest ja endonukleaasidest nagu näiteks Cas9. CRISPR on lühikesi nukleotiidseid kordusi sisaldav lookus või piirkond paljude prokarüootide DNAs, kus asuvad eri viiruste lühikesed nukleotiidsete segmentide järjestused ehk protospacer 'id. Cas9 katalüüsib CRISPRi protospacer 'iga seostunud võõra DNA ahela katkemist. Sellega neutraliseeritakse viiruse kahjulik mõju bakterile.[3][4]
Taolisi süsteeme on leitud umbes 40%-l prokarüootidest ja umbes 90%-l arhedest, kelle genoom on sekveneeritud. Cas9 avastati CRISPRi süsteemi nukleaasidest esimesena. Pärast seda on avastatud veel teisigi sarnase funktsiooniga nukleaase: Cpf, Csn, Cas3, Cas10 jne.[5]
Kuna CRISPR-Casi süsteem töötab väga spetsiifiliselt ja ei ole väga kallis, on see väga hea biotehnoloogiline vahend genoomi töötlemiseks. Võimalik, et süsteemiga võib tulevikus hakata ravima pea kõiki geneetilisi haigusi. Näiteks on Hiina teadlased seda süsteemi juba rakendanud eluvõimetu inimembrüo genoomil.[5]
Ajalugu[muuda | muuda lähteteksti]
Esimesed avastused ja vihjed selle süsteemi kohta tulid 1980ndate lõpus, kui üks Jaapani uurimisrühm kloonis kogemata ühe osa CRISPRi segmendist koos oma uuritava geeniga. Selliste korduvate järjestuste klastrid avastati veel sõltumatult kahes kohas: 1993. aastal Hollandis ja samal ajal ka Hispaanias.[6] 2005. aastal jõudsid kolm uurimisrühma üksteisest sõltumatult järeldusele, et osa CRISPRi lookuses asuvaid spacer'eid on pärit bakteriofaagide DNAst ja/või võõrast plasmiidist. Nende tulemuste järgi on CRISPRi roll bakteris sarnane omandatud immuunsüsteemiga. Esimesed katselised tõendid selle kohta saadi 2007. aastal, kui näidati, et bakteri Staphylococcus thermophilus 'e omandatud spacer 'id on tõesti pärit teda nakatanud bakteriofaagist.[7][8]
Mehhanism[muuda | muuda lähteteksti]
Kui tundmatu viirus ründab mikroobi, siis esmane immuunvastus sellele on mingi segment (protospacer) viiruse DNAst salvestada CRISPRi lookusesse. See segment on homoloogiline ehk sarnane viiruse selle piirkonna DNAga. Ensüümid, mis aitavad bakteri genoomi viiruse DNAd integreerida, on Cas1 ja Cas2. Valgumutatsiooni katsed on näidanud, et pärast seda ei lülitu enam uued protospacer 'id CRISPRi süsteemi, kuid samas on väga hästi säilinud mikroobi immuunvastus viirustele, mis on juba varem CRISPRi lookusesse lülitatud.[9]
Praeguseks on juba avastatud mitut eri tüüpi CRISPRi süsteemid (tüüp I, tüüp II, tüüp III), mis kõik töötavad teatud erinevustega. Kuna tüüp II on neist kõige enam uuritud ja nii-öelda näidis-CRISPRi süsteem, siis edaspidi tuleb juttu eelkõige just seda tüüpi süsteemist.
Võõras geneetiline materjal salvestatakse mikroobi CRISPRi klastrisse nn protospacer 'itena. Nende pikkused varieeruvad tavaliselt umbes 20 nukleotiidi ümber. Eri spacer 'id DNAs on üksteisest eraldatud lühikeste palindroomsete järjestustega. Sellelt transkribeeritud RNA-d nimetatakse CRISPRi RNA-ks ehk crRNAks (vahel mainitud ka kui guide-RNA ehk gRNA). Kuid lisaks crRNA-le on süsteemi toimimiseks vajalik veel üks teine RNA. Selleks on nn transaktiveeriv crRNA ehk tracrRNA. Selle geen on bakteri genoomis nagu Cas9 geengi CRISPRi lookuse lähedal. Sellist asukohta on vaja, et tuttava viiruse rünnaku korral välja valida just see õige, viiruse DNAga homoloogiline crRNA, ja siduda see Cas9 nukleaasiga.[10][11]
Kui sama viirus uuesti bakterit ründab, siis esmase immuunvastusena transkribeeritakse bakteri CRISPRi lookusest transkript pre-crRNA. See sisaldab veel paljusid eri protospacer 'eid ja nendega koos tulnud palindroomseid järjestusi, sellest ka eesliide pre. Samal ajal toimub ka tracrRNA süntees. See RNA sisaldab samuti palindroomset järjestust, mis on komplementaarne CRISPRis olevate korduvate järjestustega. Seejärel toimub tracrRNA hübridisatsioon just selle crRNA kõrval oleva palindroomse järjestusega, mis on homoloogiline sissetunginud viiruse DNAga. Korduste kohast tekib seega kaheahelaline ehk dsRNA (double-stranded), mis initseerib ensüümi RNase III lõikama tracrRNAga seostunud crRNAd. Pre-crRNA ja tracrRNA kompleks initseerib veel ka Cas9 ensüümi, mis seostub sellega ja alles siis muutub aktiivseks endonukleaasiks. Moodustub crRNA-tracrRNA-Cas9 kompleks, mis on nüüd valmis seostuma märklaud-DNAga. Kompleks hübridiseerub viiruse DNA selle osaga, mis sisaldab crRNAga homoloogilist järjestust, aga lisaks sellele on väga oluline veel üks järjestus, mis jääb homoloogilise järjestuse 3 otsa. Selleks on nn PAMi (protospacer adjacent motif) ala ehk protospacer 'iga külgnev järjestus, mis on ainult mõni nukleotiid pikk (3–5 aluspaar). See on väga oluline osa süsteemist, sest just see ala takistab CRISPRi süsteemil lagundada enda geneetilist infot, sest taolisi ~20 aluspaaripikkuseid spacer 'iga identseid järjestusi võib juhuslikult esineda ka bakteri enda genoomis. PAMi ala annab bakterile mõista, et tegemist on võõra geneetilise materjaliga, mis võib minna lagundamisele. Tundnud ära selle ala, hübridiseerub crRNA viiruse DNA-le, kusjuures palindroomse kordusega ala hübridiseerub just PAMi alale. Endonukleaas Cas9 katalüüsib nüüd dsDNA fosfodiestersideme katkemist. See toimub samuti PAM ala kõrval. Pärast kaheahelalist katket eemaldub kompleks märklaualt.[12]
Biotehnoloogiline rakendus[muuda | muuda lähteteksti]
CRISPR-Cas9 süsteem on oma olemuselt küllaltki lihtne, sest süsteemi toimumiseks on vaja ainult kolme komponenti: crRNA, tracrRNA ja Cas9. Teine väga oluline aspekt on, et erinevalt varasematest genoomi töötlemise tehnoloogiatest võimaldab see süsteem bioloogilisi süsteeme töödelda palju täpsemalt, kiiremalt ja odavamalt. 2011.–2012. aastal näitasid Virginijus Šikšnysi ja Emmanuelle Charpentieri juhitud uurimisrühmad, et manipuleerides RNAd Cas9 ensüümis, võivad nad ise valida märklaud-DNA ahela, mida töödelda. Näiteks valida huvipakkuv ala genoomis, tekitada seal kaheahelaline katke ja integreerida katkenud ahelate vahele uus geen. Charpentieri meeskond ühendas Cas9 ensüümis oleva RNA üheksainsaks pikemaks RNAks – guide-RNA ehk gRNAks.
Praeguseks on CRISPR-Cas9 süsteemi rakendatud sellistele organismidele nagu pagaripärm (Saccharomyces cerevisiae), sebrakala (D. rerio), äädikakärbes (Drosophila melanogaster), akselot (A. mexicanum) ja varbuss (C. elegans). Ka hiirtel, taimedel ning ahvide ja inimeste embrüotel.[13] Lisaks gRNA-le ja Cas9-le läheb vaja ka nn parandusmatriitsahelat, mille järgi DNA poolikud ahelad ära parandatakse. DNA poolikud ahelad tekivad, kui katkenud ahelate vahele on integreeritud huvipakkuv geen. Pärast huvipakkuva geeni integreerumist parandatakse need poolikud ahelad, aga tihtipeale võib nendes nukleotiidne järjestus muutuda. Selle vältimiseks ongi vaja nn parandusmatriitsahelat, et huvipakkuva geeni ümber säiliks sama nukleotiidne järjestus.[13] CRISPRit on kasutatud korraga kuni 62 geeni lõikamiseks. Et seda teha, oleks vaja just nii palju erinevaid gRNAsid, mis seostuks Cas9 nukleaasiga ja juhiks ensüümi gRNA järgi määratud kohta DNA-l.[13]
Kui Cas9 ensüümilt kõrvaldada selle nukleaasne aktiivsus, siis – kuigi kogu kompleks seostub määratud kohale DNA-l – ei lõigata seda ahelat, vaid kompleks jääb lihtsalt seotuks selle kohaga. Sellist tehnikat kasutades on huvipakkuvaid geene n-ö välja lülitatud, et uurida eri geenide funktsiooni ja mõju organismidele.[13] 2005. aastal avaldati artikkel, milles USA evolutsioonibioloogid tegid katse, kus nad kasutasid CRISPRit, et tekitada nn mutageenne ahelreaktsioon. See kandis teatud pigmentatsioonitunnuse 97% efektiivsusega järgmisesse põlvkonda. Teine uurimisrühm kasutas samuti CRISPRit ja tekitas malaariat kandnud sääskedes geenilülituse, mis aitas takistada malaariaviirust kandvate geenide levitamist. Sellest veidi hiljem andis üks uurimisgrupp teada, et oli laboritingimustes teinud teise geenilülituse, mis muutis emased sääsed viljatuks. Selle tulemusel suri terve populatsioon kiiresti välja.[
teisipäev, 25. juuli 2023
CRISPR
-
Muusika astmed ei ole noodid. Astmete redel algab 1. astmest ja lõppeb 8. astmega. Kõikide helistike heliredel algab 1. astmest. Astmetel...
-
EESTI RAHVAKALENDRI PÜHAD: JAANUAR Talvine kalapüük Mootse talus . ERA, Foto 17846. Kolmekuningapäev (6. I) Nuudipäev (7. I)...