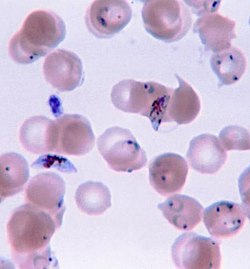
Tsütopaatiline efekt, ka tsütopatogeenne efekt (inglise keeles Cytopathic effect, lühendatult CPE), on viiruslikust infektsioonist põhjustatud struktuursed muutused peremeesrakus. Selline efekt ilmneb siis, kui nakatav viirus lüüsib raku või kui rakk ise ei suuda enam jaguneda ja sureb. Kui selliste morfoloogiliste muutuste taga on viirus, on tegemist tsütopatogeense viirusega. Kõige tavalisemad näited tsütopatogeensest efektist on peremeesraku ümardumine, kõrvalolevate rakkude liitumine üheks hulktuumseks rakuks ehk sünsüütsiumiks ning nukleaarsete või tsütoplasmaatiliste inklusioonkehakeste moodustumine.
Tsütopaatilise efekti ülesanne
Viiruslike komponentide sünteesi ajal toimuvad rakus erinevad morfoloogilised ja biokeemilised muutused. Selliseid iseloomulikke muutusi on kõige parem vaadata koekultuuris, kus saab sünkroonida rakkudega nakatamist viirusega. Samuti saab koekultuuris kasvatatud rakke uurida lihtsasti ja kiiresti ka infektsiooni käigus. Morfoloogilisi muutusi rakkudes viirusega nakatumise ajal nimetatakse tsütopaatiliseks efektiks. Selle eest vastutav viirus on aga tsütopatogeenne. See, kui tugev on tsütopaatiline efekt, sõltub viirusest, peremeesrakkudest, infektsiooniliste partiklite arvukusest (inglise keeles multiplicity of infection, lühendatult MOI) ja veel muudest teguritest. Mõned viirused põhjustavad väga madalat tsütopaatilist efekti oma looduslikes peremeesrakkudes. Selliste viiruste olemasolu rakkudes saab kontrollida ainult hemadsorptsiooniga või interferentsiga, Mõned viirused aga põhjustavad pärast infektsiooni täielikku ja kiiret peremeesraku üksikkihi hävinemist. Kuna viiruste põhjustatud tsütopaatiline efekt on spetsiifiline, siis on võimalik selle kaudu tuvastada tundmatuid viirusi. Idee klassifitseerida viirusi tsütopaatilise efekti järgi pakkus 1954. aastal välja J. F. Enders. Tema rühmitas viirusi järgmiselt:
- need, mis põhjustavad raku degradatsiooni;
- need, mis põhjustavad inklusioonkehakeste moodustumist ja rakkude degradatsiooni;
- need, mis põhjustavad hulktuumsete rakkude moodustamist;
- need, millel ei esine nähtavat tsütopaatilist efekti.
Kuigi selline informatsioon on jätkuvalt oluline, on tänapäeval olemas paremaid mehhanisme viiruste klassifitseerimiseks.
Tsütopaatilise efekti tüübid
Täielik hävitamine
Peremeesraku monokihi täielik hävitamine on tsütopaatilise efekti kõige raskem vorm. Selle uurimiseks külvatakse rakud üksikkihina pinnale, näiteks Petri tassile, nii, et nad kataksid seda täielikult. Saadud rakkude kiht nakatatakse viirusega. Kõik rakud ja nende tuumad tõmbuvad kokku ning vabanevad tassi küljest kolme päeva jooksul. Selline tsütopaatilise efekti tüüp on iseloomulik enteroviirustele.
Osaline hävitamine
Sarnaselt totaalse hävitamisega uuritakse seda nii, et külvatakse rakud üksikkihina Petri tassile ja oodatakse, et tass kasvaks täiesti täis, ning siis nakatatakse viirusega. Siin ilmneb tsütopaatiline efekt rakkude osalises lahtitulekus ja hävinemises. See on omane togaviirustele, mõnedele pikornaviirustele ja paramüksoviirustele.
Fokaalne degeneratsioon
Fokaalne degeneratsioon põhjustab lokaalset rünnakut peremehe rakkude üksikkihile. Selline tsütopaatiline efekt võib küll lõpuks koe hävitada, aga algsed staadiumid ja viiruse levik toimuvad rakkude sees lokaliseerutud viiruslikes keskustes. Selline tsütopaatiline efekt põhjustab peremeesrakkudes iseloomulikke muutusi. Rakud suurenevad, muutuvad ümaraks ja refraktiilseks. Lõpuks tulevad peremeesrakud pinna küljest ka lahti. Viiruse levik toimub nii, et lahtitulevad rakud on ümbritsetud suurenenud ümarate rakkudega, mis on ümbritsetud tervete kudedega. Sellist tsütopaatilist efekti võib näha herpesviirustel ja poksviirustel.
Paisumine ja kokkukleepumine
Paisumine ja kokkukleepumine on selline tsütopaatiline efekt, mille tagajärjel rakud paisuvad märgatavalt. Suurenedes rakud kleepuvad omavahel kokku ja moodustavad klastreid, mis näevad välja nagu viinamarjakobarad. Lõpuks tulevad rakud ka pinna küljest lahti. Selline tsütopaatiline efekt on omane adenoviirustele.
Vahutav degeneratsioon
Vahutav degeneratsioon (teisiti öeldes ka vakuoliseerumine) on degeneratsioon, mille tagajärjel moodustuvad suured ja/või arvukad vakuoolid peremeesraku tsütoplasmasse. Mitmed viiruste perekonnad, kaasa arvatud mõned retroviirused, paramüksoviirused ja flaviviirused võivad põhjustada sellist efekti. Vakuoliseerumist on keeruline näha ilma värvimiseta.
Rakkude integratsioon ehk sünsüütsium
Rakkude integratsioon ehk sünsüütsium hõlmab nelja või enama raku kokkusulamist üheks, moodustades mitmetuumse raku. Väikesed sünsüütsiumid on nähtavad ainult pärast värvimist. Mõnede paromüksoviiruste jaoks on see ainus tsütopaatilise efekti vorme. Seda kasutavad veel ka herpesviirused, kuid neil esineb ka muid vorme. Rakkude integratsiooni tuleb eristada lihtsalt kokkukleepumisest või klastrite moodustumisest.
Inklusioonkehakesed
Inklusioonkehakesed on alad rakus, mis värvuvad valikuliselt. Neid ei saa näha elusrakkude kultuuris. Selline tsütopaatiline efekt on sõltuv nakatava viiruse tüübist. Kehakesed võivad esineda üksikult või mitmekesi koos, olla suured või väikesed, ümarad või ebaregulaarse kujuga, tuumasisesed või tsütoplasmaatilised, eosinofiilsed (värvuvad roosalt) või basofiilsed (värvuvad sinakaslillalt). Võib esineda ka kromatiini marginatsioon, mille puhul põhjustab värvimine peenikese joone ümber tuuma. Enamasti näitavad inklusioonkehakesed alasid rakus, kus sünteesitakse viiruse valke või nukleiinhappeid või kohti, kus pannakse kokku virione. Mõnedel juhtudel pole inklusioonkehakeste tekkimiseks vajalik aktiivse viiruse olemasolu, sest need võivad näidata ka viiruslike armide asukohti.
Diagnostika
Mõnede viiruste tsütopaatilised efektid on ainult neile omased ning seetõttu on olulised vahendid viroloogidele diagnoosimaks nakatunud loomi ja inimesi. Viiruste identifitseerimiseks on oluline ka tsütopaatilise efekti ilmnemise tase. Kui see ilmneb koekultuuris 4–5 päeva pärast nakatumist madalama infektsiooniliste partiklite arvuga (MOI), siis võib öelda, et viirus replitseerub aeglaselt. Kui aga samadel tingimustel ilmneb 1–2 päevaga, siis loetakse sellist viirust kiiresti replitseeruvaks. Siiski tuleb arvestada, et kultuure inokuleeritaks madalama MOI-ga, sest kõrge MOI puhul ilmnevad kõik tsütopaatilised efektid kiiresti.
Esimene märk viiruslikust infektsioonist on rakkude ümardumine. Tihti ilmnevad pärast seda peremeesraku tuumas ja/või tsütoplasmas inklusioonkehakesed. Neid saab tuvastada valgusmikroskoopiaga patsiendi verest või spetsiifiliselt värvitud nakatunud koetüki lõigust. Siiski selleks, et näha tsütopaatilise efekti kõiki omadusi, on vaja kasutada elektronmikroskoopi. Inklusioonkehakesed võivad olla viiruse replikatsiooni kõrvalsaaduste kogumid või peremeesraku moondatud struktuurid. Mõned viirused põhjustavad ka sünsüütsiumite moodustumist. Need on suured tsütoplasmaatilised massid, mis koosnevad hulktuumsetest rakkudest. Need on tavaliselt põhjustatud nakatunud rakkude integratsioonist. Selle mehhanismi kaudu saab viirus liikuda nakatunud rakust nakatumata rakkudesse.
Kuna peremeesrakkudes tekkivad tsütopaatilised efektid on viirusspetsiifilised, saavad uurijad kasutada neid eksperimentides erinevuste väljatoomiseks. Paljud viirused annavad erineva vastuse, kasutades teist peremeesraku liini. Samuti saab tsütopaatilist efekti kasutada ka laboris paljundatavate rakuliinide puhtuse kontrollimiseks.