Prosenhüümne rakk on taimerakk, millel on väga piklik kuju.
Prosenhüümse raku pikkus võib küündida 25 sentimeetrini (lumivalge bömeeria).
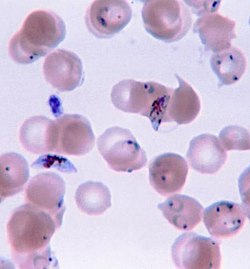
Malaaria ehk halltõbi on transmissiivsete haiguste rühm, mida põhjustavad punalibledesse elama asunud eukarüootsed algloomad per...
Prosenhüümne rakk on taimerakk, millel on väga piklik kuju.
Prosenhüümse raku pikkus võib küündida 25 sentimeetrini (lumivalge bömeeria).
Epiteelkude ehk epiteel (inglise keeles epithelial tissue, kreeka keeles thēlē 'nisa') on loomorganismi välispinda kattev ja sisepinda vooderdav või näärmeid moodustav kude. Epiteelkoed ehk epiteelid katavad nahka, limaskesti, teiste kudede vabu pindasid ja koosnevad ainult rakkudest, (rakuvaheaine praktiliselt puudub ning pole veresooni). Epiteelkoed on üks neljast loomakudede põhitüübist.
Epiteelid: ripseepiteel, näärmepiteel, transitoorne ehk üleminekuepiteel (kuseteedes esinev epiteel, mille kuju muutub) jpt.
Epiteelkude jagatakse funktsiooni alusel:
Katteepiteeli rakkude kuju järgi eristatakse:
Epiteelkoe uuenemine naha epidermises toimub üsna kiiresti, seda saab jälgida näiteks haavade paranemise kaudu (keskmiselt 4 -10 päeva).
Endotsütoos on väliskeskkonnast transportvesiikulite abil makromolekulaarsete komponentide omastamine. Makromolekulid seonduvad membraani või retseptoriga ja see põhjustab plasmamembraanist koosneva vesiikuli moodustumise ehk endosoomi, mis tagab transporditavate ainete jõudmise rakku. Makromolekulaarsed ained ei läbi passiivselt hüdrofoobset plasmamembraani ning peavad seetõttu kasutama endotsütoosi. Mõiste võttis kasutusele 1963. aastal Christian de Duve. Endotsütoosile vastupidine protsess on eksotsütoos.
Fagotsütoos esineb rakkudes, mis on spetsialiseerunud suuremate partiklite ja mikroorganismide fagotsüteerimisele ehk kahjutuks tegemisele. Imetajates on nendeks ühisest eellasest arenenud makrofaagid ehk suur-õgirakud ning neutrofiilid ehk vere valgelibled, mis suuri võõrkehi "alla neelates" moodustavad fagosoomi. Fagosoomiga interakteerudes moodustab lüsosoom fagolüsosoomi. Paljudele ainuraksetele loomadele on fagotsütoos ainus toitumisviis.
Pinotsütoos on lahustunud makromolekulide sissevõtmine väikeste vesiikulite abil. Pinotsütoos jaguneb kolmeks alatüübiks:
Lüsosoom on membraaniga ümbritsetud hüdrolüütilisi reaktsioone teostav organell ning katalüüsimisele kuuluv aine saadakse endotsütoosi teel moodustunud vesiikulitest. Kõigepealt toimub väliskeskkonnast endotsütoosi teel vesiikuli moodustumine, mis ühineb varajase endosoomiga. Seal eemaldatakse spetsiifilised retseptorid, mis transporditakse tagasi plasmamembraani koostisse. Varajased endosoomid muutuvad aja möödudes hilisteks endosoomideks, kuhu transporditakse trans-Golgi kompleksist ka happelisi hüdrolüüse. Viimati nimetatud transpordiks on vajalik mannoos-6-fosfaat retseptor, mis eemaldub hilises endosoomis ning liigub hiljem tagasi Golgi kompleksi. Hilised endosoomid muutuvad lüsosoomideks, kus algab ainete degradeerimine ehk lahustumine. Endosoomide küpsemisel mängib rolli pH langus ehk hapestumine, mida reguleerivad ATP-sõltuvad prootonpumbad ja ioonkanalid. Varajastes endosoomides on pH umbes 6,2 ning hilistes endosoomides on pH umbes 5,5.
Eksotsütoos on transportvesiikulite abil sisekeskkonnast makromolekulaarsete komponentide omastamine ning nende ühinemine raku välismembraaniga.
Mõned näited reguleeritud endotsütoosist:
Raku ruumala ja pindala on konstantsed ehk püsivad, seega endotsütoosi ja eksotsütoosi omavaheline tasakaal peab olema stabiilne, et tagada võimalikult püsiv rakusisene keskkond. Iga vesiikul on määratud ühinema ainult kindla membraaniga. Tulemuseks on makromolekulide suunatud liikumine raku sise- ja väliskeskkonna vahel. Transportvesiikulite teket katalüüsivad spetsiifilised kattevalgud. Katetena kasutatakse sihtkoha-spetsiifilisi valke:
Et transportvesiikulid tunneksid ära õige sihtmembraani, osalevad protsessis SNARE-valgud. SNARE-valgud on transmembraansed valgud, mis jagunevad vastavalt kaheks, kas valk asub vesiikulil (vSNARE) või sihtmembraanil (tSNARE). Vesiikuli ühinemine sihtmembraaniga ei toimu iseeneslikult, vajalikud on Rab perekonna GTP siduvad valgud.
Adenosiintrifosfaat ehk adenosiin-5’-(tetravesinik-trifosfaat) ehk ATP on universaalne energia talletaja ja ülekandja, mis osaleb kõigi rakkude metabolismis. ATP on makroergiline ühend.
ATP-d toodetakse kõige rohkem mitokondrites. Taimedes ja vetikates toimub intensiivne ATP moodustumine kloroplastides.
ATP koosneb adeniinist, riboosist ja kolmest lineaarselt seotud fosfaadijäägist, mis on omavahel ühendatud fosfoanhüdriidsidemetega. ATP molekuli keemiline valem on C10H16N5O13P3.
ATP avastasid 1929. aastal Harvardi meditsiinikooli teadlased Karl Lohmann,[1] Cyrus Fiske ja Yellapragada Subbarow. Selle täpne struktuur tehti kindlaks alles mõned aastad hiljem. ATP funktsiooni peamise energiakandjana rakus avastas aga teine saksa-ameerika biokeemik Fritz Albert Lipmann 1941. aastal.[2] 1948. aastal suudeti ATP’d esimest korda kunstlikult sünteesida ja sellega sai hakkama Alexander Todd.[3]
ATP on multifunktsionaalne nukleosiid trifosfaat, mida kasutatakse rakkudes koensüümina. Tihtipeale kutsutakse seda "molekulaarseks valuutaks" rakusisesel energiaülekandel.[4] Keemilise energia kandjana mängib ATP olulist rolli metabolismis ehk ainevahetuses. Lisaks on see üks fotofosforüleerimise ja raku hapnikutarbe lõpp-produkte. Rakusisestes protsessides vajavad ATP’d paljud ensüümid ja struktuurvalgud (näiteks biosünteetilistes reaktsioonides ja raku jagunemisel).[5]
Üks ATP molekul, mida toodab ATP-süntaas anorgaanilisest fosfaadist ja adenosiindifosfaadist (ADP) või adenosiinmonofosfaadist (AMP) sisaldab kolme fosfaatrühma. Adenosiintrifosfaadi sünteesiks on kolm võimalust: otsene fosfaatrühma ülekanne AMP’le või ADP’le, oksüdatiivne fosforüleerimine rakusisese hapnikutarbe käigus ja fotofosforüleerimine fotosünteesil.
Ainevahetuse protsessid, mis kasutavad ATP’d energiaallikana, muudavad selle pärast kasutamist tagasi lähteaineteks, millest seda esialgu toodeti (anorgaaniline fosfaat ning AMP või ADP). Seega on ATP organismis pidevas ringluses. Inimkeha, mis sisaldab keskmiselt kõigest 250 grammi ATP’d,[6] töötleb seda igapäevaselt ümber võrdeliselt oma kehakaaluga.[7]
ATP’d kasutatakse substraadina nii kinaaside kui ka adenülaadi tsüklaasi poolt. Kinaasid on ensüümid, mis aitavad fosfaatrühmi kõrge energiaga molekulidelt (ATP) näiteks valkudele ja lipiididele üle kanda. Adenülaadi tsüklaas katalüüsib sekundaarse virgatsaine cAMP (adenosiin-3’,5’-monofosfaadi) moodustumist.
Rakud kasutavad ATP ja AMP koguste vahelist suhet mitmeks otstarbeks. Esiteks selleks, et teha kindlaks, kui palju energiat, mida organism saaks kulutada, on saadaval. Teiseks selleks, et kontrollida metabolismiradade tegevust, mille käigus nii toodetakse kui ka tarbitakse ATP’d.[8] Lisaks mängib ATP olulist rolli DNA replikatsioonil ja transkriptsioonil. Arvatakse, et ATP näol on tegemist neurotransmitteriga, mis vahendab haistmismeele signaaliülekandeid.[9]
ATP struktuurist on näha, et see koosneb puriinalusest (adeniin), mis paikneb pentoosisuhkru (riboos) ahela esimese süsiniku aatomi (1’-süsinik) küljes. Kolm fosfaatrühma paiknevad aga pentoosisuhkru viienda süsiniku (5’-süsinik) küljes. Fosfaatrühmade liitmine ja eemaldamine võimaldab ATP muutmist ADP’ks ja AMP’ks ning vastupidi. Kui DNA sünteesil kasutatakse ATP’d, siis muudetakse riboos spetsiaalsete ensüümide (ribonukleotiidreduktaas) abil desoksüriboosiks.
ATP koosneb adenosiinist (mis omakorda koosneb adeniinist ja riboosisuhkrust) ning kolmest fosfaatrühmast (trifosfaadist). Fosfaatrühmi fosforüülgrupis nimetatakse, alustades riboosile lähimast, vastavalt alfa (α), beeta (β) ja gamma (γ) fosfaatideks. Struktuurist võib järeldada, et see on väga lähedalt seotud andenosiini nukleotiidiga ehk teisisõnu RNA monomeeriga. ATP on vees väga hästi lahustuv molekul. Äärmuslike pH’ga lahustes hüdrolüüsub ATP suure kiirusega. Lahustes, mille pH on vahemikus 6,8–7,4, on molekul küllaltki stabiilses olekus.[10]
Ilma puhveromaduseta vees muutub ATP ebastabiilseks, mistõttu see hüdrolüüsub ADP’ks ja fosfaadiks. Hüdrolüüsiprotsess leiab aset sellepärast, et sidemetugevus ATP fosfaatrühmade vahel on väiksem kui hüdrolüüsi tulemusel tekkivate produktide (ADP ja fosfaat) ning vee vahel moodustuvate vesiniksidemete tugevus. Seega kui ATP ja ADP on vesilahuses keemilises tasakaalus, siis peaaegu kogu ATP muudetakse lõpuks ADP’ks. Süsteem, mis on tasakaaluolekust kaugel, sisaldab Gibbsi vabaenergiat (ΔG) ning on seetõttu võimeline tegema tööd. Elusrakkudes on ATP ja ADP vaheline suhe 0,1 suurusjärku tasakaaluolekus esinevast suhtest kõrgem ning ATP kontsentratsioon on umbes 1000 korda suurem kui ADP kontsentratsioon. Seesugune nihe tasakaaluolekust tähendab seda, et tänu ATP hüdrolüüsile rakus eraldub suurtes kogustes vabaenergiat.[11]
ATP on niivõrd kõrge energiasisaldusega molekul tänu kahele fosfaatrühmade vahelisele sidemele. Neid sidemeid nimetatakse fosfoanhüdriidsidemedeks.[12] Energia, mis on ATP molekulis salvestatud, vabaneb eelpool mainitud anhüdriidsidemete hüdrolüüsil.[12] Energia puudujäägi korral anaboolses reaktsioonis eraldub energia saamiseks hüdrolüüsi käigus ATP’lt esimesena γ-fosfaatrühm. Kuna γ-fosfaatrühm asub riboosist võrreldes teiste fosfaatrühmadega kõige kaugemal, on sellel nii α- kui ka β- fosfaatrühmast suurem lõhustumisenergia. Pärast hüdrolüüsiprotsessi (või fotofosforüleerimise protsessi ATP’ga) moodustuvate sidemete energiatasemed on madalamad, kui ATP's leiduvate fosfoanhüdriidsidemete omad. Ensüümkatalüüsi abil aset leidva ATP hüdrolüüsi või ATP’ga fotofosforüleerimisel tekkiv vabaenergia võidakse elusolendite poolt ära kasutada töö tegemisel.[13][14]
Iga ebastabiilne süsteem, mis sisaldab reaktsioonivõimelisi molekule, võiks teoreetiliselt olla energia salvesti. See aga oleks võimalik vaid juhul, kui rakk suudaks endas säilitada antud molekuli sellise kontsentratsiooni, mis on reaktsiooni tasakaaluolekust kaugel.[11] Kuid nagu paljude teiste polümeersete biomolekulide puhul, toimub ka RNA, DNA ja ATP lagunemine lihtsamateks monomeerideks lähtuvalt energia vabanemise ja entroopia suurenemise reeglitest. Seda nii standardsete kontsentratsioonide kui ka rakus olevate kontsentratsioonide korral.
Standardset energiahulka, mis vabaneb ATP hüdrolüüsil, on võimalik välja arvutada muutuste põhjal, mis toimuvad reaktsioonis standardtingimustel. Saadud andmete abil on arvutuste tulemusi võimalik muuta nii, et need vastaks bioloogilistele kontsentratsioonidele. Reaktsioonientalpia muutus ATP hüdrolüüsumisel ADP’ks ja anorgaaniliseks fosfaadiks standardsel temperatuuril ja rõhul on −20,5 kJ/mol. Sama protsessi vabaenergia muut on 3,4 kJ/mol.[15] Eraldades 1 M kontsentratsiooniga lahuses standardtingimustel ATP’lt kas fosfaatrühma (Pi) või pürofosfaatrühma (PPi), vabanevad järgnevad energiahulgad:[16]
ATP + H2O → ADP + Pi ΔG˚ = −30,5 kJ/mol (−7,3 kcal/mol)
ATP + H2O → AMP + PPi ΔG˚ = −45,6 kJ/mol (−10,9 kcal/mol)
Neid andmeid võib kasutada, et arvutada nii energiamuutu füsioloogilistes tingimustes kui ka rakusisest ATP ja ADP vahelist suhet. Üha enam hakatakse aga kasutama sellist energiahulka, mis arvestab lisaks ATP ja ADP kogusele ka AMP kogust. Selle reaktsiooni Gibbsi vabaenergia sõltub aga mitmest muust faktorist, sealhulgas üldisest lahuse ioontugevusest ja leelismuldmetallide (nt Mg2+ ja Ca2+) sisaldusest. Tavapärastes rakusisestes tingimustes on sellise Gibbsi vabaenergia väärtus umbes −57 kJ/mol (−14 kcal/mol).[17]
Adenosiintrifosfaat sisaldab mitut asendusrühma, millel on erinevad happe dissotsiatsioonikonstandid. Neutraalses lahuses esineb ATP enamasti ioniseerunud vormis (enamus on vormis ATP4−, kuid lisaks sellele esineb ka vähesel hulgal ATP3− ioone).[18] Kuna ATP esineb neutraalses lahuses erinevates negatiivselt laetud vormides, siis võib see tänu kõrgele afiinsusele metallidega kelaatuda. Järgnevalt on toodud mõnede metalliioonide sidumiskonstandid (konstant on antud 1 mooli kohta): Mg2+ (9554), Na+ (13), Ca2+ (3722), K+ (8), Sr2+ (1381), Li+ (25).[19] Nagu konstantide väärtusest järeldada võib, moodustab ATP kompleksi enamasti Mg2+ ioonidega.
Aine- ja energiavahetus
Metabolism – organismi biokeemilised protsessid, mis tagavad aine- ja energiavahetuse ümbritseva keskkonnaga
Metabolism jaguneb kaheks: assimilatsioon (organismis toimuvate sünteesiprotsesside kogum; N: valgussüntees ja fotosüntees) ja dissimilatsioon (organismis leiduvate lagunemisprotsesside kogum; N: süsivesikute lagundamine).
Organismid jagunevad kolme rühma : autotroofid, miksotroofid ja heterotroofid.
Autotroofid on organismid, kes sünteesivad ise orgaanilist ainet, kasutades selleks valguse või keemiliste ühendite energiat. N: rohelised taimed ja osad bakterid.
Miksotroofid on organismid, kelle toitumine oleneb keskkonna tingimustest. N: roheline silmviburlane, huulhein, alpi võipätakas.
Heterotroofid on organismid, kes kasutavad oma keha ülesehitamiseks ja energia saamiseks valmis orgaanilist ainet (nt. fotosünteesi). N: loomad (k.a. inimene), seened, klorofüllita taimed, osad bakterid.
ATP – adenosiintrifosfaat
ATP on universaalne energia ülekandja.
Glükoosi lagundamine
Glükoosi varusid säilitatakse: a) taimedes tärklisena
b) glükoosina maksas ja lihastes
Glükoosi lagundamine jaguneb kolme etappi: glükolüüs, tsitraaditsükkel ja hingamisahel.
I GLÜKOLÜÜS
1) Aeroobne glükoos – toimub tsütoplasmavõrgustiku siledapinnalises osas
Lähteaineks on glükoos
Tekib 2 ATP, 4 H -> 2NADH2
2) Anaeroobne glükoos (käärimine)
a) piimhappekäärimine – läbiviijad on piimhappebakterid ja lihasrakud hapniku puuduses.
Tekib: 2 ATP-d ja piimhape
b) alkohol- e. etanoolkäärimine – läbiviijad on pärmseened ja osad bakterid
Tekib: 2 ATP-d ja etanool
Vajalikud tingimused:
a) hapniku puudus
b)kergesti omandatavate süsivesikute olemasolu
c) tekkiv etanooli hulk ei või olla väga suur
II TSITRAADITSÜKKEL – toimub mitokondri maatriksis
Lähteaineks atsetüülkoensüüm A, mis tekib glükolüüsil moodustunud püroviinamarihappest.
Kulg – eralduvad CO2 molekulid ja tekib 10 NADH2 molekuli.
III HINGAMISAHEL – toimub mitokondri sisemembraani harjakestel (sopiste tippudes)
Kulg – glükolüüsil ja tsitraaditsüklis tekkinud NADH2 energia arvel sünteesitakse ATP-d (kokku 36 ATP-d)
Fotosüntees
Fotosüntees on klorofülli sisaldavates taimerakkudes toimuv assimilatsiooniprotsess, mille käigus salvestatakse valgusenergia orgaaniliste ühendite keemiliste sidemete energiaks.
Fotosünteesi peamisteks lähteaineteks on CO2 ja H2O ning lõpp-produktiks glükoos ja hapnik.
Fotosüntees jaguneb kahte staadiumisse: valgusstaadium (nõuab valgust) –fotofüüsikaline ja fotokeemiline faas; pimedusstaadium (ei vaja valgust) – fotokeemiline faas e. Calvini tsükkel
I Valgusstaadium
1) fotofüüsikaline faas – valguse neeldumine
2) fotokeemiline faas – eristatakse kahte süsteemi:
a) fotosüsteem 2 – ergastub 680 nm valgusega
ülesanded: * toimub vee fotooksüdatsioon, mille käigus eralduvad prootonid
* veelt võetakse ära elektronid
* vee fotooksüdatsiooni produktide omavahelisel seostumisel tekib hapnik
b) fotosüsteem 1 – ergastub 700 nm juures
ülesanded: * reduktiivjõu tekitamine
*koos fotosüsteem 2-ga osalevad vesinike aatomite kontsentratsiooni eriosade tekkimisel
* lähtuvalt vesiniku aatomite kontsentratsiooni erinevustest toimub ATP süntees.
II Pimedusstaadium – fotobiokeemiline faas
Aluseks on CO2 sidumine ja muundamine stroomas paiknevate ensüümide poolt. CO2 seotakse viie süsinikulise ühendina. Esmaseks fotosünteesi produktiks on triosiid, tekib tärklis.
Fotosünteesi tähtsus: vee fotooksüdatsiooni käigus eralduv hapnik on vajalik kõigi organismide hingamiseks; fotosüntees tagab süsiniku ja hapniku ning teiste keemiliste elementide ringe.
Adenosiindifosfaat (ADP) on nukleotiid, mis koosneb adeniinist, riboosist ja kahest lineaarselt seotud fosfaadijäägist, mis on omavahel ühendatud happeanhüdriidsidemetega. Ta on pürofosforhappe ester adenosiiniga.
ADP esineb arvatavasti kõigis organismides. Ta toimib paljudes ainevahetusreaktsioonides (näiteks glükolüüsis ja hingamisahelas) energia ja fosfaadi ülekandjana.
ATP moodustub ADP-st; ATP-s talletunud energia vabanemisel hüdrolüüsis vabaneb ADP.
Eosinofiilid ehk eosinofiilsed granulotsüüdid ehk atsidofiilid (ladina keeles eosinum, eosinophilus, granulocytys acidophilus) on paljude selgroogsete lümfoid(-immuun)süsteemi fagotsüütilised leukotsüüdid.

Eosinofiilide noored vormid tekivad luuüdis. Eosinofiilide ülesandeks on suuremate parasiitide hävitamine ning allergiliste ja põletikuliste reaktsioonide modulleerimine.
Eosinofiilide areng, morfoloogia ja patoloogia võivad erineda nii liigiti, indiviiditi kui ka arenguastmeti.
Eosinofiilide nimetust kannab ka täisvereanalüüsi eosinofiilide absoluutarv (lüh EO).
Madude veres ning kudedes liikuvaid eosinofiile ei ole lõpuni uuritud, teatud autorite arvates on madudel eosinofiilid ikkagi tuvastatavad ja kirjeldatavad. Madude vereanalüüside eosinofiilide referentsväärtuste vahemikuks võetakse 0–1%.
Eosinofiilid on kantud kehtivasse inimese tsütoloogia ja histoloogia standardsõnavarasse Terminologia Histologica-sse.
Eosinofiilide hulk veres on küllalt kõikuv ja varieeruv näitaja, mis sõltub mitmetest teguritest. Eosinofiilide arvu vereproovis määratakse erinevaid automatiseeritud laboratoorse diagnostika meetodeid kasutades.
Eosinofiilide normväärtused vere automaatuuringu põhjal
| Patsiendi vanus | Referentsvahemik |
|---|---|
| sünnijärgselt | 0,0–0,84 × 109/l |
| 1 eluaasta | 0,3–0,8 × 109/l |
| 6–12 aasta | 0,1–0,5 × 109/l |
| naised | 0,0–0,4 × 109/l |
| mehed | 0,0–0,4 × 109/l |
Eosinofiilidega seostatakse inimestel mitmeid allergilisi ja haiguslikke seisundeid, näiteks eosinofiilia, eosinofiilne granuloom, eosinopeenia, eosinofiilne gastroenteriit jpt.
Gliia (vanakreeka sõnast γλία, γλοία 'liim') ehk neurogliia on närvisüsteemi kude, millel on perifeerses ja kesknärvisüsteemis mitu tugifunktsiooni, sealhulgas närvijätkete elektriline isoleerimine, rakuvälise keskkonna reguleerimine ja kaitsefunktsioon.
Gliiarakkudeks ehk gliotsüütideks nimetatakse närvisüsteemi rakke, mis ei ole närvirakud. Gliiarakke on mitut tüüpi. Need erinevad omavahel funktsiooni, ehituse ja asukoha poolest.
Esimesena kirjeldas gliia rakke saksa patoloog Rudolf Virchow 1856. aastal.
Gliiarakud moodustavad kesknärvisüsteemi ruumalast poole. Inimese ajus on umbes 86 miljardit närvirakku ja ligikaudu 85 miljardit gliiarakku, kusjuures gliiarakkude ja närvirakkude vahekord on aju eri osades oluliselt erinev. Näiteks ajukoores on gliiarakke umbes 3,7 korda rohkem kui närvirakke, samas kui väikeajus on närvirakke gliiarakkudest üle nelja korra rohkem.
Gliial on teada viis põhilist funktsiooni:
Gliiarakud sünteesivad neurosteroide.
Mikrogliia rakud ekspresseerivad D1- ja D2-dopamiiniretseptoreid. Dopamiin, toimides D1-le, reguleerib mikrogliia lämmastikoksiidi sünteesi.
Ajutrauma või infektsiooni korral mikrogliia rakud jagunevad ning vahendavad vajalikke kaitsefunktsioone.
Mikrogliia roti ajukoores (lektiini värving)
Gliiarakkude vahekorrad erinevad oluliselt sõltuvalt indiviidist. Nii näiteks tuvastati ühes uuringus eri vanuses inimeste neokorteksirakkude steroloogilise loendamise käigus, et gliiarakkudest on keskmiselt 75,6% oligodendrotsüüdid, 17,3% astrotsüüdid ja 6,5% mikrogliia ning vanuse kasvades kahaneb oligodendrotsüütide arv. Samuti leiti, et meestel on gliiarakude arv suurem kui naistel.
Inimese astrotsüüt rakukultuuris
Oligodendrotsüüt, mis moodustab mitme aksoni ümber müeliintupe
Kromafiinsed rakud on (inglise keeles chromaffin cell) on paljudel imetajatel, lindudel, roomajatel ja kahepaiksetel erinevates elundites kas üksikult (väiksearvulisena) või rakurühmadena paiknev neuroendokriinsete rakkude tüüp.
1902. aastal avastas Kohn, et need rakud värvuvad kroomi sooladega pruunikaskollaseks.
Kromafiinsete rakkude areng, anatoomia, morfoloogia, histoloogia, sünteesitavad ja eritatavad moelkulid, patoloogia ja apoptoos võivad erineda nii liigiti, indiviiditi kui ka arenguastmeti.
Kromafiised rakud liigitatakse endokriinsüsteemi hulka. Osad autorid aga liigitavad need rakud, nende tihedate seoste tõttu autonoomse närvisüsteemiga, APUD rakkude süsteemi. Varem kuulusid need rakud kromafiinsesse süsteemi.
Kromafiinsete rakkude rühmi nimetatakse vahel ka kromaffiinseks elundiks, suurim neist on Zuckerkandli elund.
Embrüoloogiliselt pärinevad need rakud neuraalharja (crista neuralis) rakkudest.
Kromafiinsed rakud sünteesivad ja vabastavad sümpaatilise närvisüsteemi mediaatoriaineid katehhoolamiine - adrenaliini, noradrenaliini, dopamiini.
Roomajate (sh madude) neerumanused paiknevad neeru peal ja histoloogiliselt on säsis paiknevad kromafiinsed rakud segunenud neerumanuse koore rakkudega.
Imetajatel on kromafiinseid rakke arvukalt just neerupealise säsis. Kromafiinsed rakud paiknevad ka sümpaatiliste närvisõlmede, uitnärvi, kõrvalnärvisõlmede, glomus caroticumi, glomus aorticumi ja kusepõie seinas, eesnäärmes ja maksa läheduses jm. Seedetraktis (soolestikus) paiknevad enterochromaffin cells.
Veislaste neerupealise säsi rakud eritavad neuropeptiididega (nagu angitensiin II, bradükiniin jt) stimuleerituna märkimisväärsetes kogustes opipoidpeptiide metioniin- ja leutsiin - enkefaliini.
Inimestel seostatakse kromafiinsete rakkudega kromafiinrakulise kasvaja kromafinoomi teket.
Karüoplasma on rakutuumasisene plasma.
See sisaldab DNA-d(desoksüribonukleotiidhape), valke, RNA-d (ribonukleotiidhape) ja erinevaid madalmolekulaarseid ühendeid. Kromosoomid on tuuma olulisimad osad. Enamikus rakkudes neid ei näe, sest kromosoomid on väga peenteks niitideks lahti keerdunud. Alles rakujagunemise alguseks pakitakse nad sedavõrd kokku, et nad muutuvad ülejäänud karüoplasmast eristatavaks.